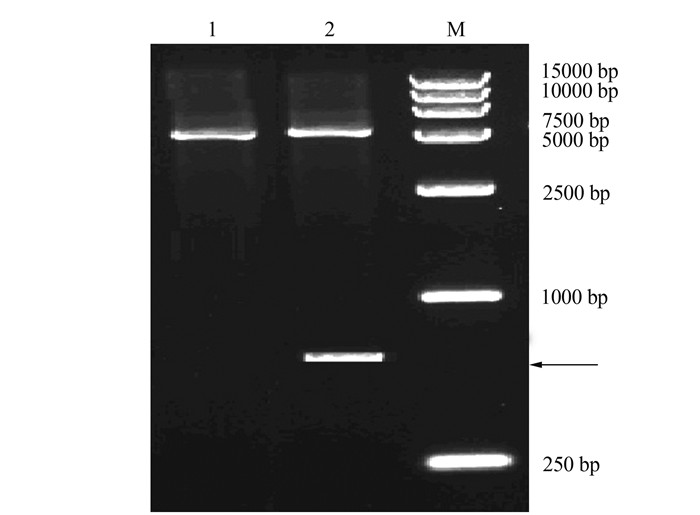
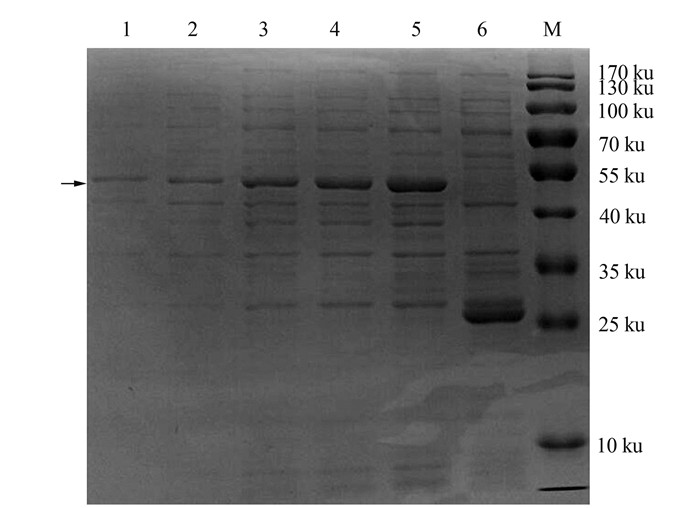
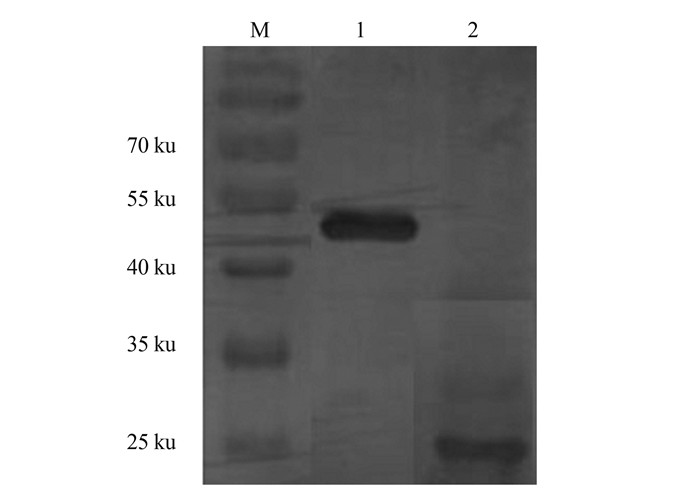
|
[1]
|
黄瑜, 苏敬良.鸭病诊治彩色图谱[M].北京:中国农业大学出版社, 2001.
|
|
[2]
|
杨晓辉, 程龙飞, 陈红梅, 等.鸭疫里默氏菌分子生物学研究进展[J].中国畜牧兽医, 2012, 39(4):183-187. http://www.cnki.com.cn/Article/CJFDTOTAL-GWXK201204049.htm
|
|
[3]
|
PATHANASOPHON P, PHUEKTES P, TANTICHAROENYOS T, et al. A potential new serotype of Riemerella anatipestifer isolated from ducks in Thailand[J]. Avian Pathol, 2002, 31(3): 267-270. doi: 10.1080/03079450220136576
|
|
[4]
|
程安春, 汪铭书, 方鹏飞, 等.我国鸭疫里默氏杆菌血清型调查及新血清型的发现和病原特性[J].中国兽医学报, 2003, 23(4):320-323. http://www.cnki.com.cn/Article/CJFDTOTAL-ZSYX200304003.htm
|
|
[5]
|
刘闯, 陈锋, 廖理克, 等.鸭疫里默氏杆菌血清型的研究进展[J].湖北农业科学, 2008, 47(3):355-357. http://www.cnki.com.cn/Article/CJFDTOTAL-HBNY200803041.htm
|
|
[6]
|
程龙飞, 李文杨, 施少华, 等.鸭疫里默氏菌基因分型[J].中国兽医学报, 2004, 24(6):545-547. http://www.cnki.com.cn/Article/CJFDTOTAL-ZSYX200406008.htm
|
|
[7]
|
程龙飞, 陈红梅, 施少华, 等.鸭疫里默氏菌的血清型及药物敏感性分析[J].中国动物传染病学报, 2013, 21(4):23-28. http://www.cnki.com.cn/Article/CJFDTOTAL-ZSJB201304007.htm
|
|
[8]
|
程龙飞, 傅光华, 牟巍, 等.鸭传染性浆膜炎二价灭活疫苗制苗用菌株的筛选[J].福建农业学报, 2014, 29(12):1164-1166. doi: 10.3969/j.issn.1008-0384.2014.12.003
|
|
[9]
|
陈红梅, 程龙飞, 傅光华, 等.6种血清型鸭疫里默氏菌SSPA基因的克隆及序列分析[J].福建农业学报, 2015, 30(9):831-835. http://www.fjnyxb.cn/CN/abstract/abstract2765.shtml
|
|
[10]
|
万春和, 程龙飞, 陈红梅, 等.鸭疫里默氏菌铁依赖抑制子基因的克隆及序列分析[J].中国畜牧兽医, 2014, 41(12):85-89. http://www.cnki.com.cn/Article/CJFDTOTAL-GWXK201412022.htm
|
|
[11]
|
万春和, 程龙飞, 邵周伍林, 等.鸭疫里默氏杆菌TaqMan荧光定量PCR检测方法的建立[J].中国预防兽医学报, 2014, 36(6):458-461. http://www.cnki.com.cn/Article/CJFDTOTAL-ZGXQ201406010.htm
|
|
[12]
|
CASSAT J, SKAAR E. Metal ion acquisition in Staphylococcus aureus: overcoming nutritional immunity[J]. Semin Immunopathol, 2012, 34(2): 215-235. doi: 10.1007/s00281-011-0294-4
|
|
[13]
|
MANFREDI P, LAUBER F, RENZI F, et al. New iron acquisition system in Bacteroidetes[J]. Infect Immun, 2015, 83(1): 300-310. doi: 10.1128/IAI.02042-14
|
|
[14]
|
ZHU Y, KUMAR S, MENON AL, et al. Regulation of iron metabolism by Pyrococcus furiosus[J]. J Bacteriol, 2013, 195(10): 2400-2407. doi: 10.1128/JB.02280-12
|
|
[15]
|
杨依菲. 1型鸭疫里默氏杆菌比较蛋白质组学研究及抗体检测方法的建立[D]. 武汉: 华中农业大学, 2012.
|
|
[16]
|
YANG Y, GU C, LIAO Y, et al. Protein expressions and their immunogenicity from Riemerella anatipestifer cultured in iron restriction medium[J]. PLoS One, 2013, 8(6): e65901. doi: 10.1371/journal.pone.0065901
|
|
[17]
|
MIETHKE M, HOU J, MARAHIEL M A. The siderophore-interacting protein YqjH acts as a ferric reductase in different iron assimilation pathways of Escherichia coli[J]. Biochemistry, 2011, 50(50): 10951-10964. doi: 10.1021/bi201517h
|
|
[18]
|
HARE N J, SOE C Z, ROSE B, et al. Proteomics of Pseudomonas aeruginosa Australian epidemic strain 1 (AES-1) cultured under conditions mimicking the cystic fibrosis lung reveals increased iron acquisition via the siderophore pyochelin[J]. J Proteome Res, 2012, 11(2): 776-795. doi: 10.1021/pr200659h
|
|
[19]
|
TU J, LU F, MIAO S, et al. The siderophore-interacting protein is involved in iron acquisition and virulence of Riemerella anatipestifer strain CH3[J]. Vet Microbiol, 2014, 168(2-4): 395-402. doi: 10.1016/j.vetmic.2013.11.027
|
|
[20]
|
LU F, MIAO S, TU J, et al. The role of TonB-dependent receptor TbdR1 in Riemerella anatipestifer in iron acquisition and virulence[J]. Vet Microbiol, 2013, 167(3-4): 713-718. doi: 10.1016/j.vetmic.2013.08.020
|
|
[21]
|
LIAO H, CHENG X, ZHU D, et al. TonB Energy Transduction Systems of Riemerella anatipestifer Are Required for Iron and Hemin Utilization[J]. PLoS One, 2015, 10(5): e0127506. doi: 10.1371/journal.pone.0127506
|
|
[22]
|
MIAO S, XING L, QI J, et al. Roles of the TonB1 and TonB2 proteins in haemin iron acquisition and virulence in Riemerella anatipestifer[J]. Microbiology, 2015, 161(8): 1592-1599. doi: 10.1099/mic.0.000123
|







 下载:
下载: