Effects of Microbial Fertilizers on Growth and Defense-related Enzymes of Continuously Cropped Cucumbers
-
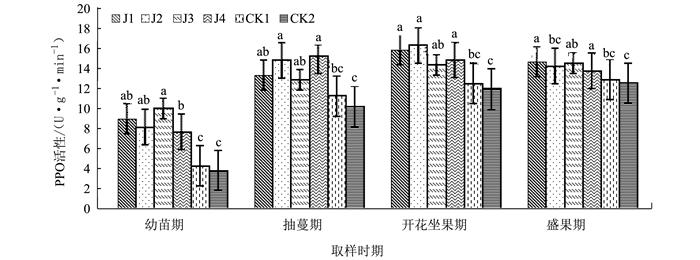
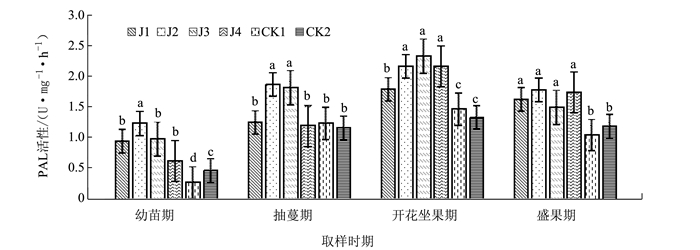
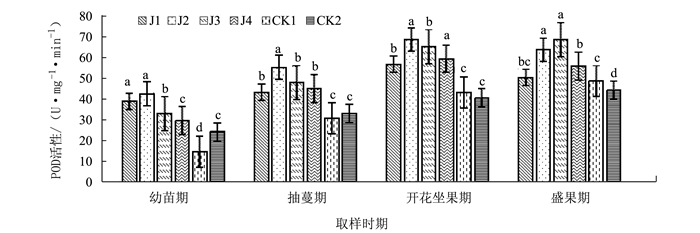
摘要: 为探明微生物菌肥与连作黄瓜生长及相关防御性酶的关系,在黄瓜连作土壤中添加4种不同的微生物菌肥,研究微生物菌肥处理土壤对黄瓜不同时期的生长和其叶片防御性酶活性的影响。结果表明,4种微生物菌肥均能不同程度促进连作黄瓜的生长,黄瓜各个生长时期叶片的过氧化物酶的活性增强,多酚氧化酶和苯丙氨酸解氨酶活性呈现先增后降的趋势,微生物菌肥在一定程度上能够诱导黄瓜的系统抗病性。Abstract: Various microbial fertilizers were applied on the soil that grew continuous crops of cucumbers. The growth and the activities of defense-related enzymes of the cucumbers cultivated on the ground applied with 4 different microbial fertilizers were monitored. All tested fertilizers promoted the growth in varying degrees. With the fertilization, POD activities in the cucumber leaves at different developmental stagesincreased, while PPO and PAL activitiesraised initially followed by a decline. The microbial fertilizersseemed to induce a systemicresistance to diseasesin the cucumber plants.
-
Key words:
- cucumber /
- microbial fertilizer /
- continuous cropping /
- defense-related enzymes
-
表 1 4种微生物菌肥参数
Table 1. Information on four microbial fertilizers
名称 主要菌群 性状 活菌数 绿士达生根菌肥 枯草芽孢杆菌、生根放线菌、康氏木霉菌、巨大芽孢杆菌 土黄色粉剂 枯草芽孢杆菌≥2.0亿个·g-1、生根放线菌≥4亿个·g-1、康氏木霉菌≥2.0亿个·g-1、巨大芽孢杆菌≥2.0亿个·g-1 柏威霉素微生物菌剂 胶质芽孢杆菌、地衣芽孢杆菌、放线菌、枯草芽孢杆菌、圆褐固氮菌 深褐色粉剂 有效活菌数≥2.0亿个·g -1 绿都菌剂1号解淀粉芽孢杆菌 解淀粉芽孢 黑褐色粉剂 有效活菌数≥100亿个·g -1 重茬120沃根微生物菌肥 枯草芽孢杆菌、细黄莲霉素 粉红色粉剂 有效活菌数≥2000万个·g -1 表 2 不同微生物菌肥处理土壤对黄瓜生长的影响
Table 2. Effect of microbial fertilizerson growth of cucumbers
取样时期 处理 株高
/cm径粗
/mm植株总干质量
/g叶面积
/cm2幼苗期 J1 36.1±1.2a 3.56± 0.31a 3.23± 0.07a 177.7± 13.2a J2 35.1±1.1a 3.24± 0.52ab 3.07± 0.12a 217.3± 9.3a J3 34.1±0.9a 2.96± 0.26b 2.88± 0.09b 159.6± 5.4b J4 28.6±1.1b 2.33± 0.43c 2.99± 0.11b 150.0± 7.7bc CK1 27.2±1.4b 2.04± 0.28cd 2.06± 0.08c 112.9± 3.6c CK2 22.5±0.8c 1.86± 0.41d 2.37± 0.09bc 123.9± 9.7c 抽蔓期 J1 138.8±1.7ab 5.20± 0.57ab 5.13± 0.11a 368.9± 12.5b J2 143.9±1.9a 5.72± 0.32a 5.75± 0.09a 361.8± 18.2b J3 128.4±1.8ab 4.78± 0.36b 4.13± 0.14b 419.6± 19.2a J4 123.0±2.1b 4.15± 0.29b 4.48± 0.13b 333.4± 15.4bc CK1 82.7±1.5c 4.04± 0.33bc 3.47± 0.07c 296.7± 11.7d CK2 95.3±1.6c 3.74± 0.41c 3.88± 0.09c 304.6± 9.8c 开花坐果期 J1 176.9±2.2a 7.54± 0.082a 13.48± 0.15ab 717.3± 26.1a J2 161.5±2.3a 7.00± 0.63a 14.43± 0.23a 593.8± 21.3b J3 156.7±1.9ab 6.20± 0.19ab 12.60± 0.17b 636.6± 7.4b J4 160.1±1.6a 6.58± 0.28a 11.24± 0.14c 683.3± 10.2ab CK1 140.4±1.8b 5.68± 0.42b 10.74± 0.09c 576.7± 14.5bc CK2 132.1±1.9b 5.16± 0.31b 10.27± 0.10c 529.4± 13.6c 盛果期 J1 188.5±1.8a 8.37± 0.63a 17.78± 0.32a 797.3± 25.7a J2 176.5±2.1a 8.02± 0.45a 16.90± 0.26ab 693.8± 20.3b J3 172.1± 2.3a 7.75± 0.59ab 17.45± 0.35a 706.6± 19.6b J4 179.9± 2.2a 7.61± 0.62ab 16.28± 0.19b 743.3± 18.7a CK1 169.± 2.1ab 6.70± 0.48b 14.34± 0.17c 606.7± 23.1c CK2 156.1± 1.9b 7.02± 0.31b 15.75± 0.11b 659.4± 17.2bc 注:同列数据后不同小写字母表示差异达显著(P < 0.05)水平。 -
[1] 刘杰, 吴凤芝, 周新刚.连作及轮作土壤微生物菌群对黄瓜幼苗生长及土壤酶活性的影响[J].中国蔬菜, 2015(5):38-42. http://d.old.wanfangdata.com.cn/Periodical/zgsc201505010 [2] 张学鹏, 宁堂原, 杨燕, 等.不同浓度石灰氮对黄瓜连作土壤微生物生物量及酶活性的影响[J].应用生态学报, 2015, 6(10):3073-3082. http://d.old.wanfangdata.com.cn/Periodical/yystxb201510020 [3] HARRMMERSCHMIDT R, NUCKLES E M, KUC J.Association of enhanced peroxidase activity with in ducedsys ternicresistance of cucumber to colletotrichurn lagenarium[J]. Physiol Plant Pathol, 1982, 20:73-82. doi: 10.1016/0048-4059(82)90025-X [4] PATRA K H, MISHRA D N. Pyrophosphatase, peroxidase and polyphenoloxidase actixities during leaf development and senescence[J].Plant Physiol, 1979, 63:318-323. doi: 10.1104/pp.63.2.318 [5] DICKERSON D P, PASCHOLATI S F, EHAGERMAN A, et al.Phenylalanineammonia-lyase and hydroxycinnamate:CoA hgase in maize mesocoryls inoculated with Helminthosporium maydis or Helminthosporium carbonum[J]. Physiol Plant Pathol, 1984, 25:111-123. doi: 10.1016/0048-4059(84)90050-X [6] 唐艳领, 李杰, 蔡毓新, 等.丛枝菌根真菌对连作黄瓜根际土壤的影响[J].中国瓜菜, 2018, 31(2):15-18. http://d.old.wanfangdata.com.cn/Periodical/zgxgtg201802004 [7] LIU L, KLOEPPER J W, TU ZUN S.Incduion of sysemic resistance in cucumber against Fusariumwilt by plant growth-promotingrhizobacteria[J].Phytopathology, 1995, 85(6):695. doi: 10.1094/Phyto-85-695 [8] 令利军, 冯蕾, 雷蕾.等.地衣芽孢杆菌TG116诱导黄瓜抗病性相关防御酶系的研究[J].西北师范大学学报(自然科学版), 2016, 52(1):100-104. http://d.old.wanfangdata.com.cn/Periodical/xbsfdxxb201601020 [9] 王涛, 乔卫花, 李玉奇, 等.轮作和微生物菌肥对黄瓜连作土壤理化性状及生物活性的影响[J].土壤通报, 2011, 42(3):578-583. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=TRTB201103014&dbname=CJFD&dbcode=CJFQ [10] 王涛, 辛世杰, 乔卫花, 等.几种微生物菌肥对连作黄瓜生长及土壤理化性状的影响[J].中国蔬菜, 2011(18):52-57. http://d.old.wanfangdata.com.cn/Periodical/zgsc201118010 [11] 张俊英, 许永利.两株生防菌对连作土壤中黄瓜生长及微生物的影响[J].北方园艺, 2015(15):28-31. http://d.old.wanfangdata.com.cn/Periodical/bfyany201515006 [12] 郝永娟, 魏军, 刘春艳, 等.生物土壤添加剂对连作黄瓜防御酶系及酚类物质含量的影响[J].植物病理学报, 2009, 39(4):444-448. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=ZWBL200904017&dbname=CJFD&dbcode=CJFQ [13] 赵贞, 杨延杰, 林多, 等.微生物菌肥对日光温室黄瓜生长发育及产量品质的影响[J].中国蔬菜, 2012(18):149-153. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=ZGSC201218032&dbname=CJFD&dbcode=CJFQ [14] 赵佳, 杜宾, 聂园军, 等.施用生物有机肥对连作黄瓜生长及根际微环境的影响[J].中国瓜菜, 2017, 30(1):31-34. http://d.old.wanfangdata.com.cn/Periodical/zgxgtg201701009 [15] 张志良, 翟伟菁.植物生理学实验指导(第3版)[M].北京:高等教育出版社, 2003. [16] 梁郸娜, 胡其靖, 曹磊, 等.蚜虫侵染对黄瓜叶片中丙二醛含量及保护酶活性的影响[J].江苏农业学报, 2016, 32(2):278-284. http://d.old.wanfangdata.com.cn/Periodical/jsnyxb201602007 [17] 董春娟, 李亮, 曹宁, 等.苯丙氨酸解氨酶在诱导黄瓜幼苗抗寒性中的作用[J].应用生态学报, 2015, 26(7):2041-2049. http://d.old.wanfangdata.com.cn/Periodical/yystxb201507017 [18] HOLZAPFEL C, SHAHROKH P, KAFKEWITZ D.Polyphenol oxidase activity in the roots of seedlings of Bromus (Poaceae) and other grass genera[J]. American Journal of Botany, 2010, 97:1195-1199. doi: 10.3732/ajb.0900337 [19] VOGT T. Phenylpropanoid biosynthesis[J].Molecular Plant, 2010, 3:2-20. doi: 10.1093/mp/ssp106 -






 下载:
下载: