Nested RT-PCR Assay for Detecting Broad bean wilt virus 2 and Turnip mosaic virus in Pseudostellaria heterophylla
-
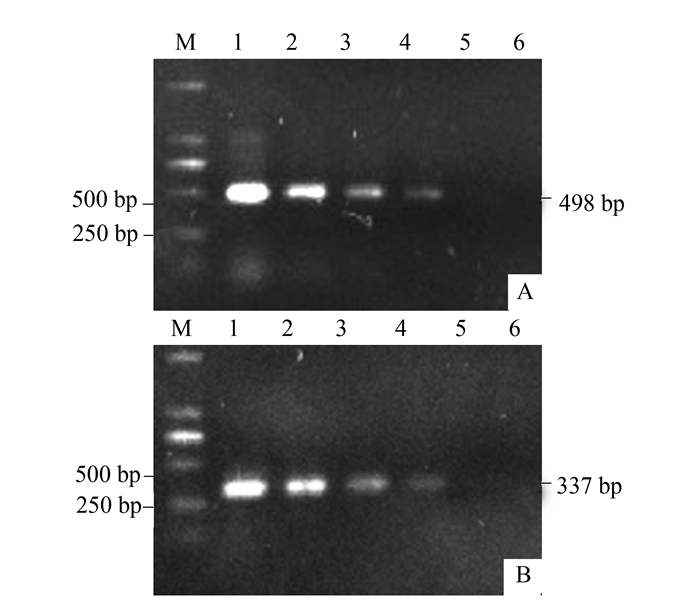
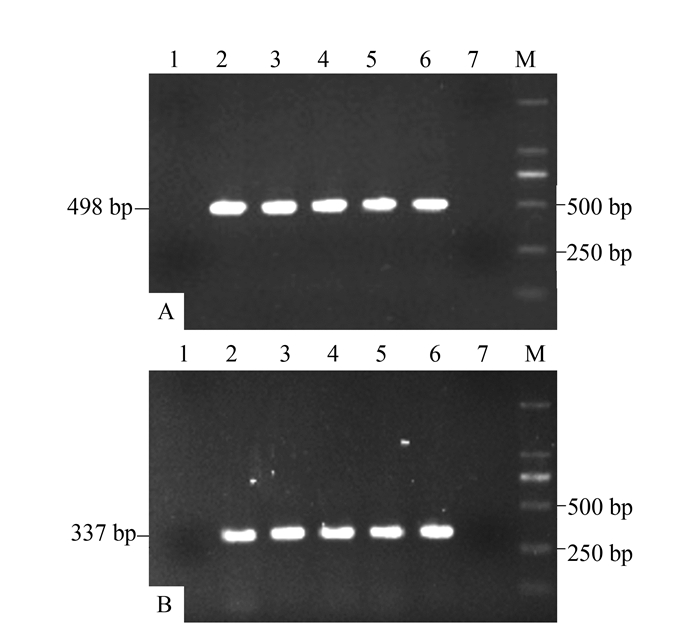
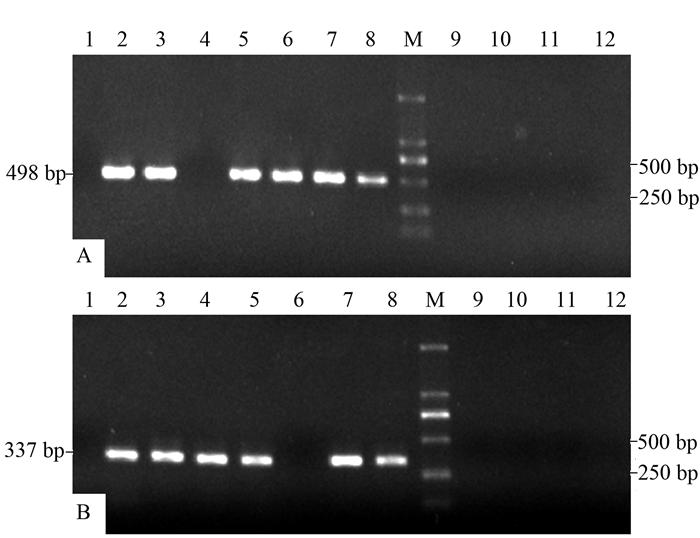
摘要: 为探求快速、灵敏的太子参脱毒检测技术,建立太子参蚕豆萎蔫病毒2(Broad bean wilt virus 2,BBWV2)和芜菁花叶病毒(Turnip mosaic virus,TuMV)的巢式RT-PCR快速检测方法,根据GenBank数据库中这2种病毒外壳蛋白(coat protein,cp)基因核苷酸序列的保守区域分别设计2对简并引物,建立和优化巢式RT-PCR扩增体系,继而进行常规RT-PCR和巢式RT-PCR灵敏度的比较,并应用巢式RT-PCR对7份田间栽培太子参病样和4份脱毒苗样品进行检测。结果显示:BBWV2、TuMV的巢式引物最佳退火温度分别为60、62℃;采用巢式RT-PCR,这两种病毒样品cDNA原液在稀释105倍后仍能扩增出特异性条带,比常规RT-PCR的灵敏度至少高10倍。本研究建立的巢式RT-PCR检测方法可快速、稳定、准确地检测BBWV2和TuMV,且具有更高的灵敏度,更能满足太子参脱毒检测的需要。
-
关键词:
- 太子参 /
- 太子参蚕豆萎蔫病毒2(BBWV2) /
- 芜菁花叶病毒(TuMV) /
- 巢式RT-PCR
Abstract: To enable a rapid and sensitive determination of being virus-free for a Pseudostellaria heterophylla seedling, a nested RT-PCR method was developed. Detection of the presence of either Broad bean wilt virus(BBWV2) or Turnip mosaic virus(TuMV) in the sample was a proof of the existence of the diseases. Two pairs of degenerate primers were designed respectively according to the conserved sequence regions of the two coat protein (cp) genes of the viruses from GenBank. The nested RT-PCR detection protocols were optimized. Subsequently, detecting sensitivities of the conventional and the nested RT-PCRs were compared. Meanwhile, 7 samples of cultivated P. heterophylla along with 4 of virus-free test-tube plantlets were used in a challenge test on the nested RT-PCR methodology. The results showed that, by using the annealing temperature of 60℃ for BBWV2 and 62℃ for TuMV on the nested primers, specific bands could be detected on a 105x dilution of the first strand cDNA for both viruses. That suggested at least 10-fold higher a sensitivity was achieved by the nested than the conventional RT-PCR. It was concluded that the newly established assay method was rapid, stable, sensitive and accurate for detecting BBWV2 or TuMV in P. heterophylla, and therefore, could be adequately applied to certify a virus-free status or not on a P. heterophylla sample. -
表 1 BBWV2和TuMV的巢氏RT-PCR检测引物
Table 1. Nested RT-PCR primers for BBWV2 and TuMV identification
引物名称 引物序列(5′-3′) 目的片段大小
/bp退火温度
/℃BBWV2--F TTGGGHTCWAGYYTGGGACGYTTRT 1345 57 BBWV2-R TTRTARAACTTCTTGCTCCCACGM BBWV2-NF AAYGCTCCRAARGTVGATGCYARRA 498 - BBWV2-NR CBCCTCTTGCYGARTCYAAATCCCA TuMV-F AGGTGAAAYGCTTGATGCAGGTY 775 60 TuMV-R GTTHCCATCCARKCCGAACAAAT TuMV-NF TCATCTRATYCTRTACACGCCRGAGC 337 - TuMV-NR TGTATGGTCGGTCTTGGTTACGC -
[1] 匡云波, 陈满足, 陆伊荣, 等.太子参芜菁花叶病毒和蚕豆萎蔫病毒的双重RT-PCR检测[J].园艺学报, 2017, 44(4): 784-791. https://www.cnki.com.cn/qikan-YYXB201704019.html [2] 吴朝峰, 马雪梅, 林彦铨.太子参茎尖脱毒培养及增产效果[J].福建农业大学学报, 2006, 35(2): 129-133. http://cdmd.cnki.com.cn/Article/CDMD-10389-2004109240.htm [3] 朱艳, 秦民坚, 周小华.太子参脱病毒技术研究[J].植物资源与环境学报, 2005, 14(4): 27-31. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zwzyyhjxb200504006 [4] 颜培玲, 王振华, 靳志飞, 等.太子参的组织培养与快速繁殖研究[J].安徽农学通报, 2016, 22(23): 50-52. doi: 10.3969/j.issn.1007-7731.2016.23.019 [5] 高玮, 张敬水, 张建红, 等.太子参花叶病毒的检测与防治[J].中国病毒学, 1993, 8(4): 390-393. http://www.cnki.com.cn/Article/CJFDTotal-HBNK201316067.htm [6] 黄颖桢, 陈菁瑛, 朱景花, 等.太子参中芜菁花叶病毒的RT-PCR检测[J].福建农业学报, 2016, 31(6): 616-619. http://www.cnki.com.cn/Article/CJFDTotal-FJNX201606012.htm [7] LEE S, LEE G, CHOI I C, et al. Development of PCR diagnostic system for detection of the seed-transmitted Tobacco ringspot virus in quarantine[J]. Indian Journal of Microbiology, 2015, 55(2): 231-233. doi: 10.1007/s12088-015-0518-8 [8] KOMOROWSKA B, MALINOWSKI T, MICHALCZUK L. Evaluation of several RT-PCR primer pairs for the detection of Apple stem pitting virus[J]. J Virol Methods, 2010, 168(1-2): 242-247. doi: 10.1016/j.jviromet.2010.04.024 [9] ZHANG P, LIU Y, LIU W, et al. Simultaneous detection of Wheat dwarf virus, Northern cereal mosaic virus, Barley yellow striate mosaic virus and Rice black-streaked dwarf virus in wheat by multiplex RT-PCR[J]. J Virol Methods, 2017, 249170-249174. http://cn.bing.com/academic/profile?id=ea31f20a5375489a1fc2999de3851c0a&encoded=0&v=paper_preview&mkt=zh-cn [10] MALANDRAKI I, BERIS D, ISAIOGLOU I, et al. Simultaneous detection of three pome fruit tree viruses by one-step multiplex quantitative RT-PCR[J]. Plos One, 2017, 12(7): e0180877. doi: 10.1371/journal.pone.0180877 [11] KAJIWARA H, MURAKAMI R. Application of RT-PCR and MALDI-TOF MS for the detection of RNA luteovirus[J]. Anal Biochem, 2017, 53945-53947. http://cn.bing.com/academic/profile?id=1a0a935a53502aa98083717ec1ce56d4&encoded=0&v=paper_preview&mkt=zh-cn [12] DAN M, LI S, YU K X, et al. Detection of ratoon stunting disease in virus-free Seedcane of Saccharum officinarum by PCR[J]. Agricultural Science & Technology, 2010, 11(11-12): 111-113. http://cn.bing.com/academic/profile?id=a0a6fe37af1eaafb233c008a731599c4&encoded=0&v=paper_preview&mkt=zh-cn [13] 傅华英, 葛丹凤, 李晓燕, 等.甘蔗赤条病菌巢式PCR检测[J].植物保护学报, 2017, 44(2): 276-282. http://www.oalib.com/paper/4451714 [14] 沈万宽, 刘睿, 邓海华.甘蔗宿根矮化病菌巢式PCR检测[J].植物保护学报, 2012, 39(6): 508-512. http://www.oalib.com/paper/4451714 [15] DEY K K, LIN H, BORTH W B, et al. A highly sensitive single-tube nested PCR assay for the detection of Pineapple mealybug wilt associated virus-2(PMWaV-2)[J]. J Virol Methods, 2012, 183(2): 215-218. doi: 10.1016/j.jviromet.2012.03.025 [16] ADKAR-PURUSHOTHAMA C R, MAHESHWAR P K, SANO T, et al. A sensitive and reliable RT-nested PCR assay for detection of Citrus tristeza virus from naturally infected citrus plants[J]. Curr Microbiol, 2011, 62(5): 1455-1459. doi: 10.1007/s00284-011-9883-7 [17] 匡云波, 叶炜, 李金辉, 等.不同产地太子参芜菁花叶病毒CP基因的分离与序列差异性分析[J].热带作物学报, 2016, 37(10): 1974-1979. doi: 10.3969/j.issn.1000-2561.2016.10.021 [18] 匡云波, 叶炜, 李金辉, 等.太子参蚕豆萎蔫病毒2号CP基因的遗传多样性及分子进化分析[J].植物病理学报, 2017, 47(4): 470-478. http://www.cqvip.com/QK/91986X/201001/33123287.html [19] 宋荣浩, 濮祖芹.太子参(Pseudostellaria heterophylla)病毒病病原鉴定[J].上海农业学报, 1991, 7(2): 80-85. http://www.cqvip.com/qk/91627X/199102 [20] 陆家云.药用植物病害[M].北京:中国农业出版社, 1995. [21] 黄勇毅, 林丛发.闽东太子参花叶病发病规律调查及防治途径研究[J].宁德师专学报(自然科学版), 2004, 16(1): 65-68. http://www.cnki.com.cn/Article/CJFDTOTAL-FJND200602003.htm [22] 刘清琪, 陈棣华.太子参花叶病病原及其防治的初步研究[J].中药材科技, 1983(2): 11-12. http://mall.cnki.net/magazine/Article/ZYCA198302009.htm [23] 朱晨熹, 王国平, 郑亚洲, 等.来源于猕猴桃的柑橘叶斑驳病毒的RT-PCR检测及外壳蛋白基因序列分析[J].植物病理学报, 2016, 46(1): 11-16. http://www.cqvip.com/QK/91986X/201601/667711923.html [24] 沈建国, 高芳銮, 蔡伟, 等.进境大豆种子上菜豆荚斑驳病毒和大豆花叶病毒的多重RT-PCR检测[J].中国农业科学, 2016, 49(4): 667-676. doi: 10.3864/j.issn.0578-1752.2016.04.006 [25] 金晶, 付翔, 沈建国, 等.利用多重RT-PCR检测水仙黄条病毒、水仙退化病毒和水仙花叶病毒[J].福建农林大学学报(自然科学版), 2015, 44(5): 462-467. http://industry.wanfangdata.com.cn/dl/Detail/Periodical?id=Periodical_fjnydxxb201505003 [26] 闻伟刚, 崔俊霞, 赵秀玲, 等.半巢式RT-PCR检测进口大豆中菜豆荚斑驳病毒的研究[J].植物病理学报, 2006, 36(4): 296-300. http://mall.cnki.net/magazine/Article/ZWBL200604001.htm [27] 贾平乔, 周国梁, 吴杏霞, 等.进境苹果果实中梨火疫病菌的套式PCR检测[J].植物病理学报, 2009, 39(5): 1-9. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zwblxb200905001 -







 下载:
下载: