A RT-PCR Assay for Quantitative Detection of Bovine Viral Diarrhea Virus
-
摘要:
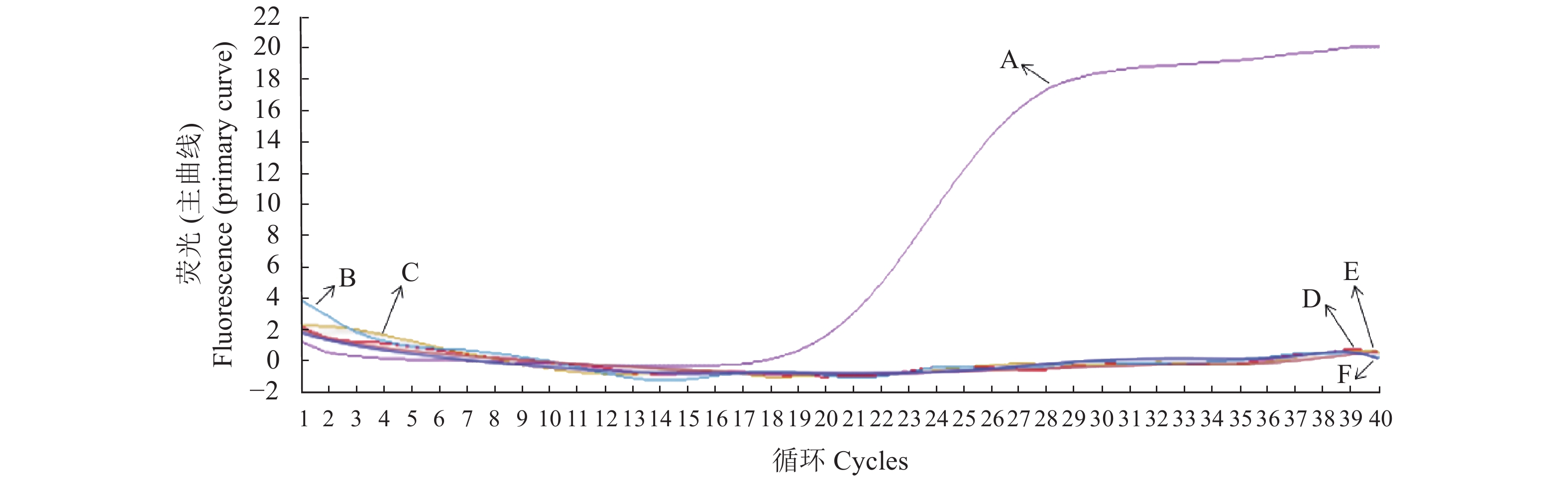
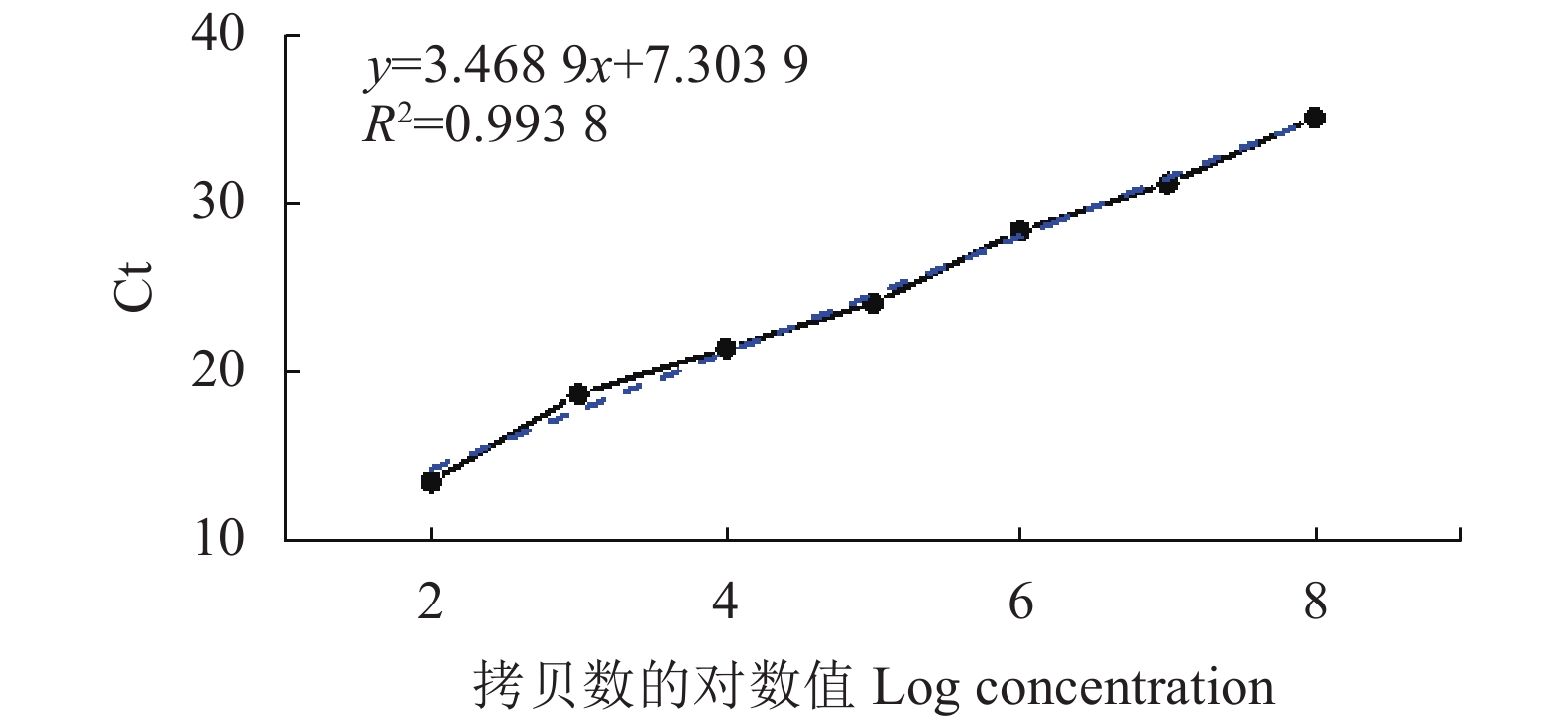
目的 设计一种能够快速检测出牛病毒性腹泻病毒(bovine viral diarrhea virus, BVDV)的方法。 方法 依据GenBank公布的BVDV 5′UTR基因属于特异性保守区域的前提,构建具有特异性的探针和引物,以体外转录病毒RNA作为绝对定量标准品。对荧光定量RT-PCR方法的各反应条件进行优化,创建BVDV荧光定量PCR检测方法。 结果 5.026 7 copies·μL−1是此检测方法的最低下限值,该方法拥有良好的重复性,变异系数在组内、组间均<1%。特异性较高,对其他病毒核酸的扩增均为阴性,如猪瘟病毒、口蹄疫病毒等。 结论 建立的BVDV荧光定量PCR方法敏感性高、特异性强、重复性好,为牛病毒性腹泻的早期诊断提供了重要的技术支撑。 Abstract:Objective A rapid detection and quantification method for bovine viral diarrhea virus (BVDV) was established. Method For the methodology development, specific primers and probes were designed based on the target regions of the BVDV 5′UTR gene published by GenBank. The RNA of in vitro transcription viruses was used as the absolute quantitative standard. Reaction conditions of the fluorescent quantitative RT-PCR were optimized. Result The newly developed assay had a minimum detection limit of 5.0267copies/μL and an intragroup variation coefficient of less than 1% with high repeatability and specificity. Other than BVDV, it amplified no viral nucleic acids of viruses such as swine fever and foot-and-mouth diseases. Conclusion The established fluorescence quantitative RT-PCR method was highly sensitive, specific, and repeatable in detecting and quantifying BVDV. It appeared appropriate for early diagnosis of bovine viral diarrhea. -
Key words:
- Bovine viral diarrhea virus /
- 5′UTR /
- RT-PCR /
- standard RNA
-
表 1 引物和探针
Table 1. Primers and probes applied
引物名称
Primers引物序列(5′→3′)
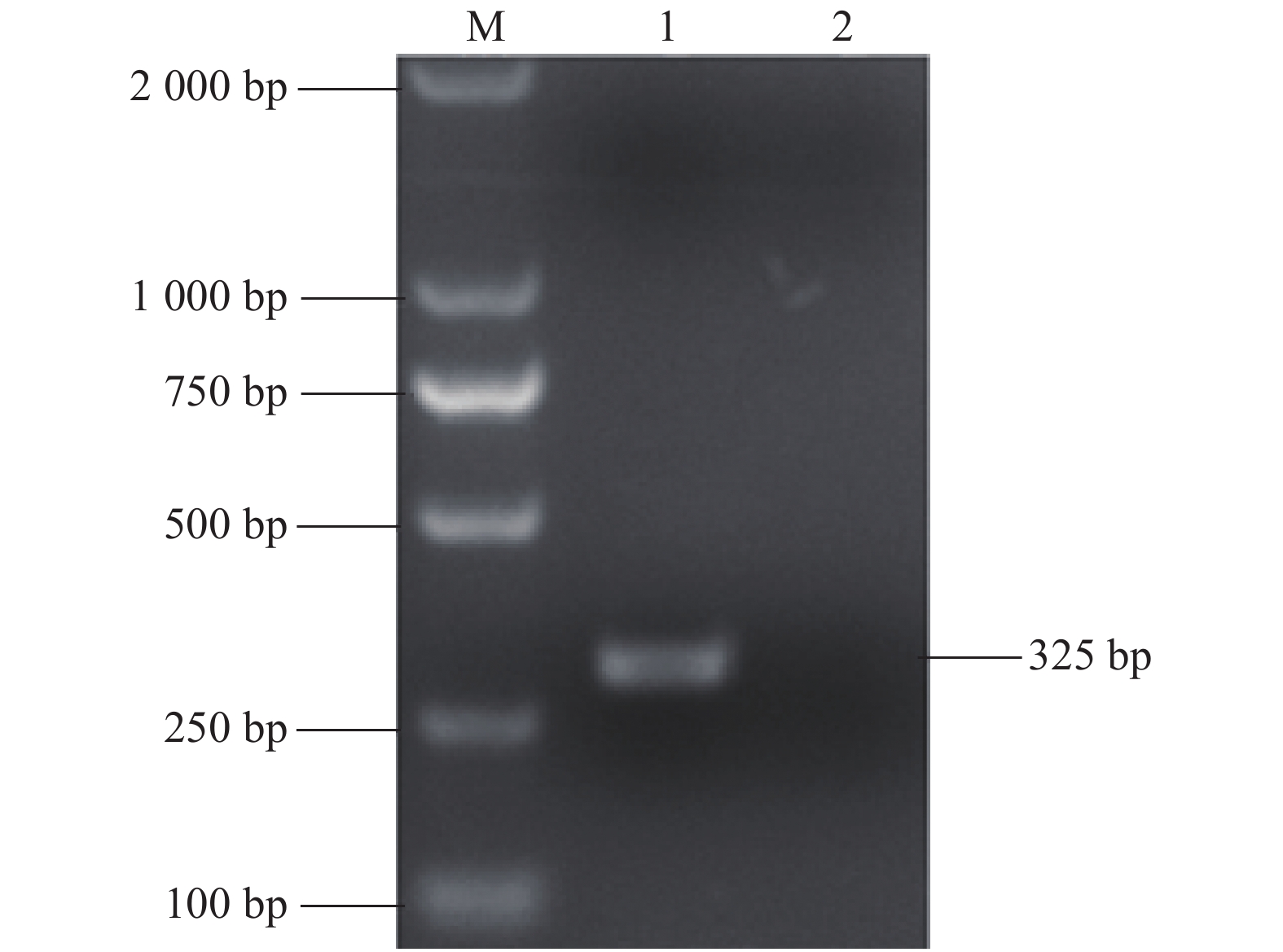
Primer sequences(5′-3′)目的片段大小/bp
Product size/bpA-F TAATACGACTCACTATAGGG-CATGCCCATAGTAGGAC 325 B-R TTTTTTTTTTTTTTTTTTTTTTT CCATGTGCCATGTACAG Q-F GAGGGTAGCAACAGTGGTGA 76 Q-R AGGCGTCGAACCACTGACG 探针 FAM-GTGGTGAGTTCGTTGGATGGCT-BHQ1 表 2 核酸浓度
Table 2. Nucleic acid concentration
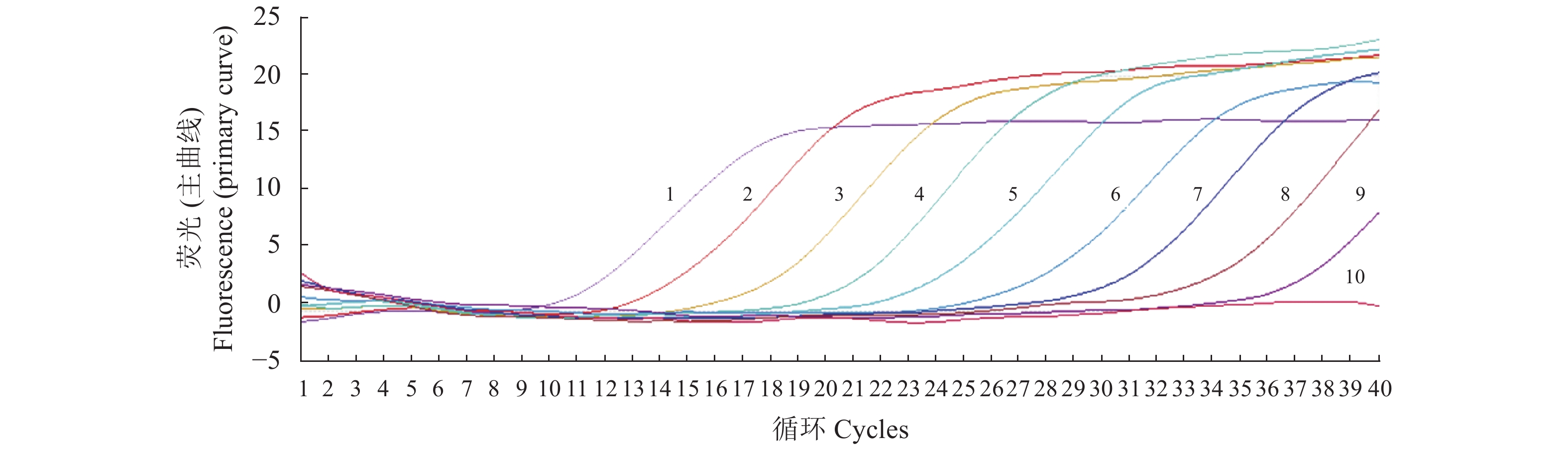
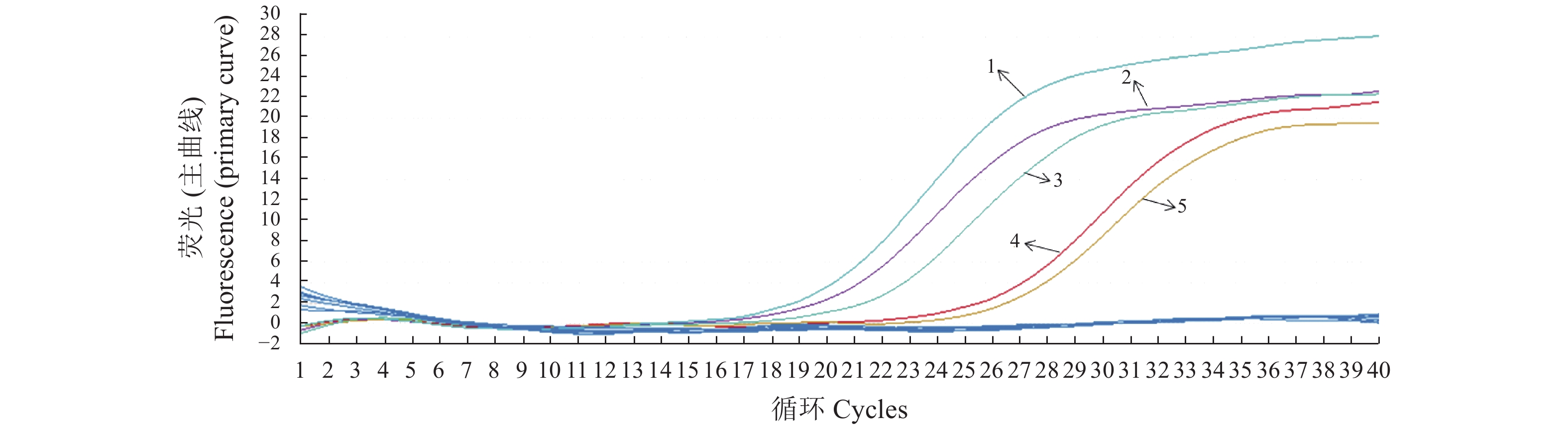
扩增曲线
Amplification curve核酸浓度
Nucleic acid concentration(copies ·μL−1)1 5.026 7×108 2 5.0267×107 3 5.026 7×106 4 5.026 7×105 5 5.026 7×104 6 5.026 7×103 7 5.026 7×102 8 5.026 7×101 9 5.026 7 10 0.502 67 表 3 实时荧光定量PCR方法的变异系数
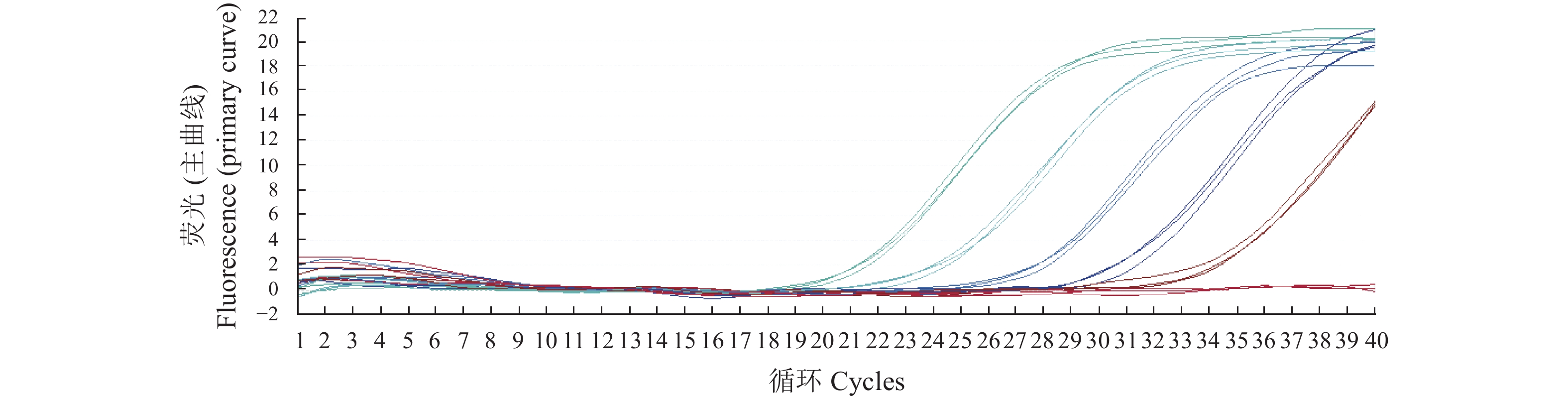
Table 3. Coefficients of variation between inter- and intra-groups of RT-PCR assay
稀释度
Dilution rate组内重复性 Reproducibility intra-batch 组间重复性 Reproducibility inter-batch Ct平均值
Ct average values组内变异系数
Coefficient of variation/%Ct平均值
Ct average values组间变异系数
Coefficient of variation/%浓度1 21.82±0.12 0.55 21.79±0.08 0.37 浓度2 25.31±0.19 0.75 24.93±0.49 1.97 浓度3 28.63±0.27 0.94 28.45±0.16 0.56 浓度4 31.21±0.27 0.87 31.27±0.07 0.22 浓度5 35.65±0.27 0.76 35. 14±0.48 1.37 -
[1] BECHER P, THIEL H J. Pestivirus[M]//The Springer Index of Viruses. New York, NY: Springer New York, 2011: 483-488. [2] VILČEK Š, PATON D J, DURKOVIC B, et al. Bovine viral diarrhoea virus genotype 1 can be separated into at least eleven genetic groups [J]. Archives of Virology, 2001, 146(1): 99−115. doi: 10.1007/s007050170194 [3] RIDPATH J F, BOLIN S R, DUBOVI E J. Segregation of bovine viral diarrhea virus into genotypes [J]. Virology, 1994, 205(1): 66−74. doi: 10.1006/viro.1994.1620 [4] PETERHANS E, BACHOFEN C, STALDER H, et al. Cytopathic bovine viral diarrhea viruses (BVDV): Emerging pestiviruses doomed to extinction [J]. Veterinary Research, 2010, 41(6): 44. doi: 10.1051/vetres/2010016 [5] MOENNIG V, LIESS B. Pathogenesis of intrauterine infections with bovine viral diarrhea virus [J]. Veterinary Clinics of North America:Food Animal Practice, 1995, 11(3): 477−487. doi: 10.1016/S0749-0720(15)30462-X [6] BAKER J C. The clinical manifestations of bovine viral diarrhea infection [J]. The Veterinary Clinics of North America Food Animal Practice, 1995, 11(3): 425−445. doi: 10.1016/S0749-0720(15)30460-6 [7] HOUE H. Economic impact of BVDV infection in dairies [J]. Biologicals, 2003, 31(2): 137−143. doi: 10.1016/S1045-1056(03)00030-7 [8] REICHEL M, HILL F, VOGES H. Does control of bovine viral diarrhoea infection make economic sense? [J]. New Zealand Veterinary Journal, 2008, 56(2): 60−66. doi: 10.1080/00480169.2008.36809 [9] LANYON S R, SIMS S K, COCKCROFT P D, et al. Comparison of serum, ear notches, and nasal and saliva swabs for Bovine viral diarrhea virus antigen detection in colostrum-fed persistently infected (PI) calves and non-PI calves [J]. Journal of Veterinary Diagnostic Investigation, 2014, 26(6): 783−787. doi: 10.1177/1040638714550181 [10] DRISKELL E A, RIDPATH J F. A survey of bovine viral diarrhea virus testing in diagnostic laboratories in the United States from 2004 to 2005 [J]. Journal of Veterinary Diagnostic Investigation, 2006, 18: 600−605. doi: 10.1177/104063870601800615 [11] 李家伟, 郭利, 杨勇, 等. 牛病毒性腹泻病毒LAMP检测方法的建立与应用 [J]. 中国畜牧兽医, 2015, 42(12):3111−3118.LI J W, GUO L, YANG Y, et al. Establishment and application of LAMP detection method of bovine viral diarrhea virus [J]. China Animal Husbandry & Veterinary Medicine, 2015, 42(12): 3111−3118.(in Chinese) [12] 范晴, 谢芝勋, 刘加波, 等. 牛病毒性腹泻病毒实时荧光定量RT-PCR检测方法的建立 [J]. 动物医学进展, 2010, 31(10):10−14. doi: 10.3969/j.issn.1007-5038.2010.10.003FAN Q, XIE Z X, LIU J B, et al. Establishment of real-time flourescent quantitative PCR for detection of bovine viral diarrhea virus [J]. Progress in Veterinary Medicine, 2010, 31(10): 10−14.(in Chinese) doi: 10.3969/j.issn.1007-5038.2010.10.003 [13] 胡俊英, 鲁海冰, 常晓冉, 等. 基于单抗捕获牛病毒性腹泻病毒(BVDV)抗原ELISA方法的建立及应用 [J]. 中国兽医学报, 2019, 39(3):401−407.HU J Y, LU H B, CHANG X R, et al. Development of a sandwich ELISA for capture of bovine viral diarrhea virus antigen and epidemiological investigation [J]. Chinese Journal of Veterinary Science, 2019, 39(3): 401−407.(in Chinese) [14] 王荣, 李文文, 王研, 等. 牛病毒性腹泻病毒实时荧光定量RT-PCR方法的建立及应用 [J]. 中国畜牧兽医, 2014, 41(2):35−39.WANG R, LI W W, WANG Y, et al. Establishment and application of real-time fluorescent quantitative RT-PCR method for detection of bovine viral diarrhea virus [J]. China Animal Husbandry & Veterinary Medicine, 2014, 41(2): 35−39.(in Chinese) [15] 国家市场监督管理总局, 国家标准化管理委员会. 牛病毒性腹泻/粘膜病诊断技术规范: GB/T 18637—2018[S]. 北京: 中国标准出版社, 2018. [16] MACKAY I M, ARDEN K E, NITSCHE A. Real-time PCR in virology [J]. Nucleic Acids Research, 2002, 30(6): 1292−1305. doi: 10.1093/nar/30.6.1292 [17] ZIMMER G M, VAN MAANEN C, DE GOEY I, et al. The effect of maternal antibodies on the detection of bovine virus diarrhoea virus in peripheral blood samples [J]. Veterinary Microbiology, 2004, 100(3/4): 145−149. [18] DENG M L, JI S K, FEI W T, et al. Prevalence study and genetic typing of bovine viral diarrhea virus (BVDV) in four bovine species in China [J]. PLoS One, 2015, 10(4): e0121718. doi: 10.1371/journal.pone.0121718 [19] 付运星, 吴永丽, 徐道修, 等. 犬瘟热病毒一步法荧光定量PCR检测方法的建立 [J]. 中国兽医学报, 2016, 36(3):407−411.FU Y X, WU Y L, XU D X, et al. Development of real-time PCR assay for detection and quantification of the canine distemper virus [J]. Chinese Journal of Veterinary Science, 2016, 36(3): 407−411.(in Chinese) [20] 李占鸿, 廖德芳, 杨振兴, 等. 帕利亚姆血清群病毒一步法RT-PCR检测技术的建立 [J]. 中国预防兽医学报, 2020, 42(1):40−45.LI Z H, LIAO D F, YANG Z X, et al. The development of a one-step RT-PCR assay for the detection of PALV [J]. Chinese Journal of Preventive Veterinary Medicine, 2020, 42(1): 40−45.(in Chinese) -






 下载:
下载: