2. 福建省宁德市富发水产有限公司, 福建 宁德 352000;
3. 福建省水产技术推广站, 福建 福州 350003
2. Ningde Fufa Fisheries CO.LTD, Ningde, Fujian 352000, China;
3. Fujian Provioncial Aquatic Technology Extension Station, Fuzhou, Fujian 350003, China
大黄鱼Pseudosciaena crocea(Richardson)隶属鲈形目、石首鱼科、黄鱼属,据统计2010年,我国人工养殖大黄鱼总产量达8.6万t,直接产值60多亿元,年出口创汇近亿美元,大黄鱼成为我国8大优势出口养殖水产品之一,福建省是大黄鱼的主养区,2012年产量约占我国大黄鱼总产量的 90%[1],由于养殖环境不断恶化,大黄鱼病害的危害程度愈发严重,“内脏白点病”是大黄鱼的主要病害之一,王国良等[2]认为大黄鱼“内脏白点病”的病原为诺卡菌;沈锦玉[3]、邱杨玉[4]等报道了大黄鱼“内脏白点病”病原为假单胞菌。2013年2~5月,福建省宁德三都澳海水网箱养殖大黄鱼发生“内脏白点病”,病鱼体表和鳃基本完好、镜检未见寄生虫,少数鱼鳃部有零星白色结节,剖检病鱼可见脾肿大、肾糜烂,脾、肾出现直径0.5~1.0 mm 的白色结节,发病后期病鱼肝脏也出现同样的白点,累计死亡率可达50%以上。为探究该病的病因与行之有效的防治方法,本研究进行病原分析和药物筛选等试验,以期为海水鱼疾病的防治提供科学依据。
1 材料与方法 1.1 试验用鱼具有典型内脏白点症状的大黄鱼于2013年3月采自福建省宁德市三都澳海水网箱大黄鱼养殖场,体长20~30 cm,体重200~400 g。用于回归感染试验的健康大黄鱼,体长15~20 cm,体重100~200 g。
1.2 细菌的分离与培养无菌操作用接种环从病鱼的脾、肾等部位取样划线分离至TSA(1%NaCl)和TCBS平板培养基,于28℃恒温培养24 h,挑取优势单菌落进行纯化培养,获得2株待测菌株分别命名为 H2013032002和H2013032003,原始菌株于-40℃甘油冻存;工作菌株4℃保存备用。
1.3 细菌的回归试验试验方法参考文献[5]并加以改进,待测细菌接种于TSB液体培养基28℃培养24h后,调节菌液含量至5.0×106cfu·mL-1。将已暂养1周的健康大黄鱼分为注射组、浸泡组、灌胃组和对照组共4组,每组15尾。腹腔注射剂量为每尾注射0.25 mL;灌胃剂量为每尾灌胃1.0 mL;浸泡剂量为5.0×106 cfu·mL-1,浸泡24 h;对照组则不感染细菌。水温18~20℃、连续观察8 d。记录大黄鱼死亡与发病情况,并对死亡大黄鱼及时剖检,并进行致病菌的再次分离。
1.4 分离菌的鉴定 1.4.1 形态学观察观察接种于TSA(1%NaCl)和TCBS平板于28℃恒温培养24 h 的菌落的颜色、形态、透明度等菌落特征;并对纯化菌落进行革兰氏染色,通过显微镜观察菌体形态。
1.4.2 生理生化特性按API-20E生化鉴定系统操作说明书进行,分别挑取待测细菌单个菌落,用5 mL生理盐水稀释混匀制成菌悬液,再加入到API-20E生化试剂条中,28℃恒温培养,根据API-20E判读表判定各反应结果,记录后输入梅里埃API鉴定软件分析,判定结果。
1.4.3 分离菌株16S rRNA 基因序列的PCR 和序列分析参考Martin等[6]的方法,合成1对16S rRNA特异性通用引物进行PCR扩增(目标片段约1 500 bp),上游引物P1: 5′-AGAGTTTGATC(C/A)TGGCTCAG-3′;下游引物P2:5′-TACGG(C/T)TACCTTGTTACGACTT-3′(上海生工生物工程公司合成)。提纯分离菌基因组DNA作为PCR模板,PCR反应体系为: 94℃预变性5 min,94℃ 变性30 s、55℃ 退火1 min、72℃延伸 1 min,完成30个循环后,72℃延伸 10 min。反应完毕各取5 μL PCR 产物进行1%琼脂糖凝胶电泳。PCR 产物经DNA胶回收试剂盒(型号BSP049,上海生工生物工程公司)回收纯化,纯化片段连接至PMD19 载体,转化至感受态大肠杆菌DH5α。取少量菌液涂至含Amp(100 μg·mL-1)、IPTG(24 μg·mL-1)、X-Gal(40 μg·mL-1)LB平板,37℃培养过夜;挑单个白色菌落于含Amp(100 μg·mL-1)LB培养液中,37℃ 210 r·min-1 培养12 h。提取克隆质粒,经Hand Ⅲ 和 Bam Ⅱ双酶切,酶切产物进行1%琼脂糖凝胶电泳,阳性克隆菌液送去测序(上海生工生物工程公司),所得序列通过软件NCBI BLAST进行比对,并以MEGA 5.0 软件构建其系统发育树。
1.5 药物敏感试验按纸片法操作,无菌条件下,于TSB扩增培养菌液至1.0×107 cfu·mL-1;吸取菌液1.0 mL至TSA平板并涂布;再将抗生素药敏纸片(杭州微生物试剂有限公司)贴于培养基表面,28℃ 恒温培养18 h,测量抑菌圈直径。依照参考文献 [7]规定的CLSI标准判断敏感特性。
2 结果与分析 2.1 病鱼症状观察如图 1 所示,病鱼外观表面基本无明显症状;剖检可见脾脏、肾脏出现明显白色结节,直径0.5 ~1.0 mm,严重病鱼肝脏也会出现白点。

|
图 1 患病大黄鱼内脏症状 Fig. 1 Symptoms of white-spots disease on organs of croaker |
H2013032002腹腔注射健康大黄鱼后在2 d后不同程度发病,大黄鱼出现状态下降,第4 d后开始出现死亡,到第8 d时,所有注射组大黄鱼全部死亡;浸泡组大黄鱼出现离群、翻肚等发病症状,第8 d出现3尾死亡;灌胃组大黄鱼发病症状同上,但未出现死亡;对照组正常存活且未出现任何疾病症状。其中死亡大黄鱼剖检症状与自然发病大黄鱼症状相似,且从病鱼脾、肾用TSA平板再次划线分离细菌并检测,结果显示其形态与生化特性与H2013032002株一致。
2.3 病原的分离与鉴定 2.3.1 形态观察待测菌株革兰氏染色后显微镜观察为革兰氏阴性、杆状。在28℃条件下,在TSA平板上的细菌培养24 h生长良好,形成的单菌落形状呈圆形,色泽淡黄色,菌落边缘整齐,直径约0.5 mm; 在TCBS 平板上细菌生长缓慢,24~48 h 可见绿色菌落。
2.3.2 生理生化鉴定分离菌H2013032002和H2013032003生化特性一致(表 1),主要特性表现为: 氧化酶阳性,精氨酸双水解酶阳性,利用柠檬酸钠盐;葡萄糖、甘露醇、蔗糖阴性,不产生明胶酶、H2S等。经法国梅里埃API-20E鉴定软件分析,恶臭假单胞菌或荧光假单胞菌的阳性率为75.2%。
|
|
表 1 分离菌的生理生化特性 Tab.1 Biochemical characteristics of isolated pathogens |
分离菌基因组DNA通过16S rRNA-PCR扩增获得了约1 500 bp 的特异性条带(图 2);2株分离菌纯化回收的PCR 产物经测序,16S rRNA基因序列长度均为1 459 bp,用Clustalx2.0比对,2株菌的16SrRNA序列100%一致,证实这2株菌株为同一种细菌。
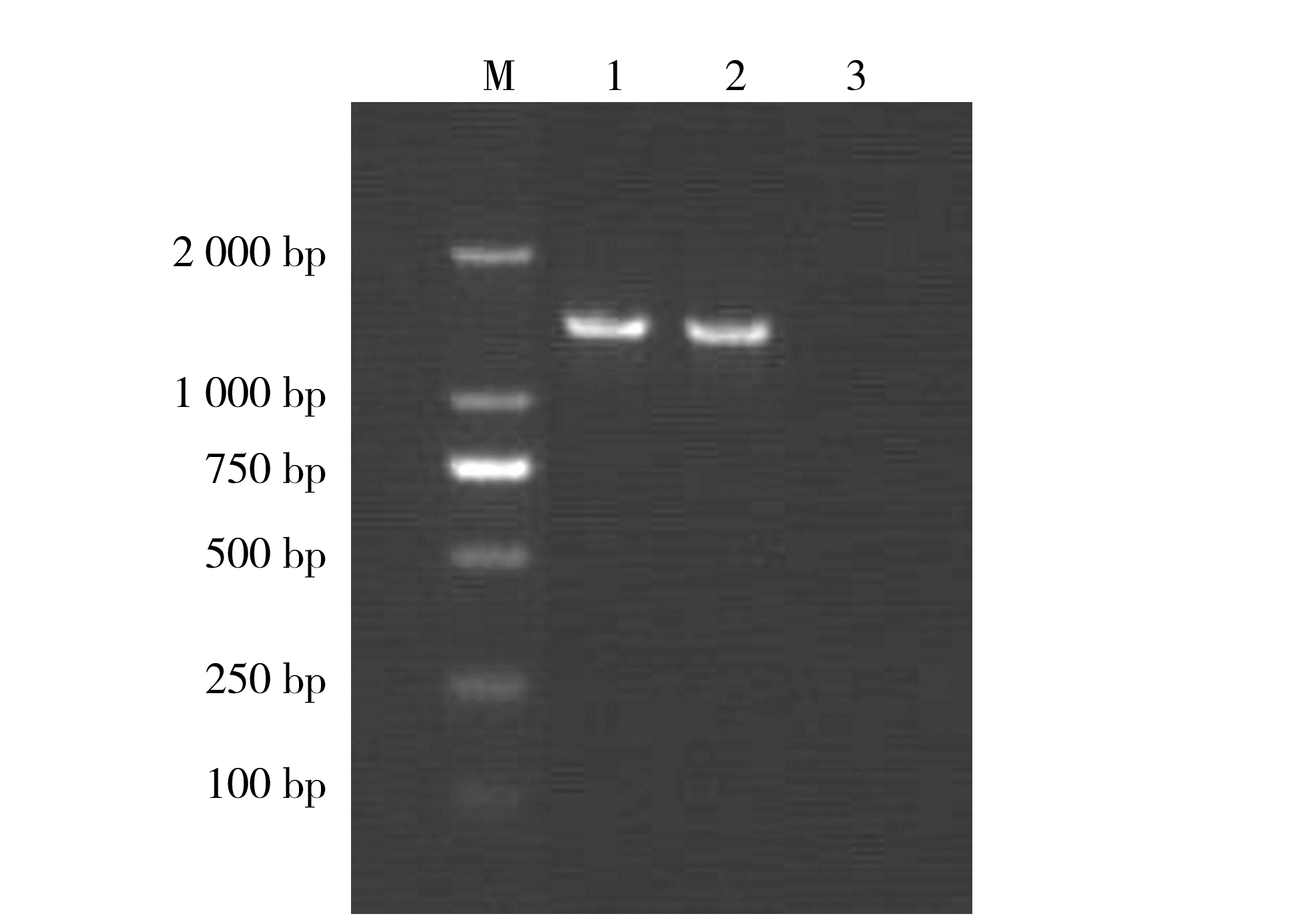
|
图 2 16S rRNA-PCR 扩增电泳结果 Fig. 2 Electrophoresis of 16S rRNA PCR amplification 注: M为DL2000 marker; 1、2 分别为H2013032002和H2013032003进行16S rRNA PCR产物; 3为空白对照。 |
菌株的16S rRNA基因序列GenBank数据库中假单胞菌属的16S rRNA基因序列自然聚类,在相近的135个序列中,有133个假单胞菌属的16S rRNA基因序列,其中38个属恶臭假单胞菌群内种,95个属未定种名假单胞菌属菌。分离菌株与恶臭假单胞菌群内菌株的同源性高达99%以上,选取恶臭假单胞菌群内的3个种,假单胞菌属内其他6个群的菌株各1个种,以及氮单胞菌、莫拉氏菌、嗜水气单胞菌、大肠杆菌、巴斯德杆菌等14个已知序列号(表 2),经MEGA5.0构建系统发育树(图 3),如图 3所示,菌株宁德H2013032003与EU661866.1(P.putida)、U191931.1(P.monteilii)和JQ659931.1(P.plecoglossicida)聚为1个分支,置信度为99%,表明菌株H2013032002或H2013032003与恶臭假单胞菌(P.putida)亲缘关系最近。结合形态和理化特性结果,可确定菌株H2013032002和H2013032003为恶臭假单胞菌。
|
|
表 2 构建系统发育树的16S rRNA基因序列及其数据库存取号 Tab.2 Phylogenetic dendrogram constructed from GenBank and access number of isolated strains |
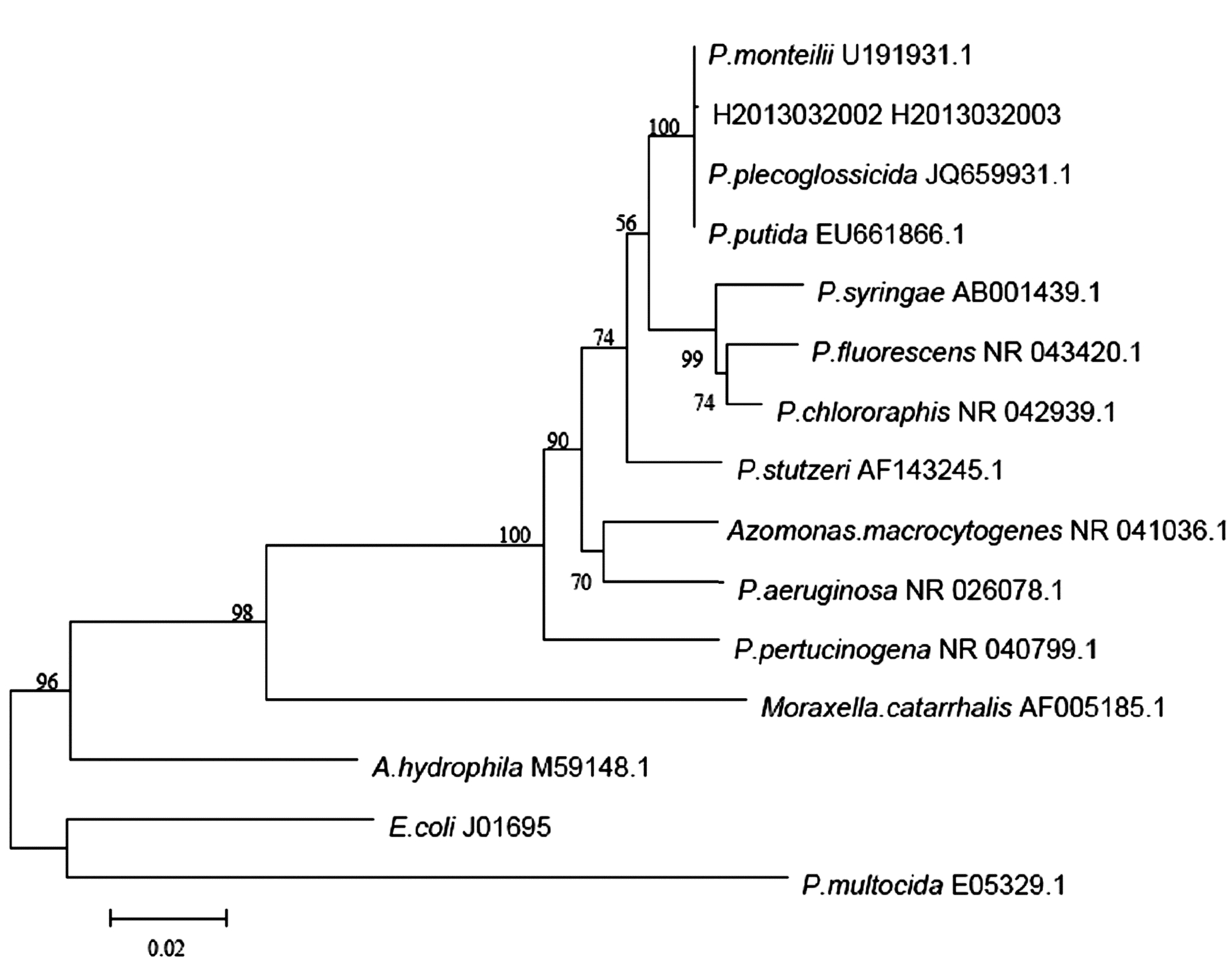
|
图 3 16S rRNA 基因构建的系统发育树 Fig. 3 Phylogenetic tree based on 16S rRNA genes |
用K-B法测定了病原菌对11 种常用抗菌药物的敏感性(表 3),参照CLSI的标准可知:病原菌对诺氟沙星、环丙沙星、恶喹酸、卡那霉素等4种药物高度敏感;对青霉素G、四环素、羧卡青霉素、痢菌消、灭菌灵和氟苯尼考等6种药物不敏感;对强力霉素中等敏感。
|
|
表 3 细菌药物敏感试验 Tab.3 Sensitivity of pathogens to antibiotics |
假单胞菌是水中常见的菌群,为条件致病菌,能引起世界各地的温水性或冷水性的海、淡水鱼发病,其致病性主要取决于水环境的理化性质及鱼体的生理状态。而恶臭假单胞菌是引起假单胞菌病的一种常见的致病菌,经常可以在腐臭的鱼中检出,已报道恶臭假单胞菌可引起欧洲鳗鲡Anguilla anguilla烂鳃病[8]、中华绒螯蟹Eriocheir sinensis爪无力[9]、三疣梭子蟹Portunus trituberculatus牛奶病[10]、罗氏沼虾Macrobrachium rosenbergii黄鳃和黑鳃病[11]、黑鲷Sparus macrocephalus肠炎[12]。本研究分离鉴定的恶臭假单胞菌H2013032002或H2013032003与近年来不同学者于春季在不同海域患内脏白点病或结节病的大黄鱼分离到的病原菌[3, 4, 13, 14]相似,可见,该病在春季有广泛流行趋势,应引起重视。
3.2 大黄鱼内脏白点病的病原分析水产疾病普遍存在“症状相似但病原不同”现象,就大黄鱼内脏白点病为例:春季低水温期不同海域养殖大黄鱼出现肝、脾、肾等内脏白色结节,经鉴定其病原主要为假单胞菌[3, 4, 13, 14];而夏秋季高水温期患内脏白点病的大黄鱼有见其病原为诺卡菌的报道[2, 15],却未见其病原为假单胞菌的报道。本研究从春季患内脏白点病的大黄鱼脏器内分离到的病原菌16S rRNA序列与假单胞菌属的多个16S rRNA基因序列的同源性为99%,但是一般认为,16S rRNA序列同源性小于97%,可以认为属于不同的种;同源性小于93%,可以认为属于不同的属[16] 。这说明假单胞菌属16S rRNA 基因序列的种间差异不显著,也说明了只靠16S rRNA 基因序列同源性分析不能对亲缘关系较近的假单胞菌种之间做出明确地鉴别。因此再结合经典的生化鉴定结果,确定了菌株H2013032002被鉴定为恶臭假单胞菌。至于能否推断大黄鱼内脏白点病春季发生的病原是假单胞菌、而秋季发生的病原是诺卡菌,还需进一步确证。
3.3 大黄鱼内脏白点病的防治患内脏白点病的大黄鱼外观症状不明显,从而给海水网箱养殖大黄鱼内脏白点病的诊断和防治增加了难度。因此,应按“早发现、预防为主、科学用药”原则,及时观察并剖检异常鱼、分析可能原因、送至有条件的水产部门进行确证和药物筛选,本研究分离的致病菌H2013032002或H2013032003经药物敏感试验结果显示该菌对喹诺酮类药物如诺氟沙星、环丙沙星、噁喹酸等敏感,生产上基于药物消退时间和药物效果等综合因素考虑建议按说明书及时拌料口服使用诺氟沙星,并加强管理,更有利于防治大黄鱼内脏白点病。本研究的回归感染试验结果显示浸泡和灌胃均可导致试验鱼发病,提示了不新鲜、腐败变质的饵料和不良水体均有可能是重要传染源;为了防治大黄鱼内脏白点病须消除传染源、切断传播途径并提高机体自身免疫力,还需进行内脏白点病的流行病调查、细菌致病机理研究和鱼类的免疫机制探讨等,为预防和控制大黄鱼内脏白点病提供科学思路。
| [1] | 农业部渔业局. 2013中国渔业统计年鉴[M].北京:中国农业出版社,2013:5.( 1) 1) |
| [2] | 王国良,袁思平,金珊,等.大黄鱼结节病病原菌一诺卡氏菌的鉴定及其系统发育分析[J].中国水产科学,2006,13(3):410-413.( 2) 2) |
| [3] | 沈锦玉,余旭平,潘晓艺,等.网箱养殖大黄鱼假单胞菌病病原的分离与鉴定[J].海洋水产研究,2008,29(1):1-6.( 3) 3) |
| [4] | 邱杨玉,郑磊,毛之娟,等. 大黄鱼(Larimichthys crocea)内脏白点病的病原分离和组织病理学观察[J].微生物学通报,2012,39(3):361-370.( 3) 3) |
| [5] | 杜宗君,黄小丽,邓永强,等.人工养殖大鲵病原荧光假单胞菌的分离鉴定[J].四川农业大学报,2011,29(1):103-107.( 1) 1) |
| [6] | MARTIN F P. Bias in Template-to-Product Ratios in Multitemplate PCR[J]. Applied and Environmental Microbiology,1998,64(10):3724-3730.( 1) 1) |
| [7] | Clinical and Laboratory Standards Institute(CLSI). Performance standards for antimicrobial susceptibility testing: 17th informational supplement [S].USA,Pennsylvania,2007.( 1) 1) |
| [8] | 樊海平.恶臭假单胞菌引起的欧洲鳗鲡烂鳃病[J].水产学报,2001,25(2):147-150.( 1) 1) |
| [9] | 余为一,李槿年,祖国掌.一株中华绒螫蟹病原菌的研究初报[J].安徽农业大学学报,1999,26(2):174-177.( 1) 1) |
| [10] | 王高学,黄增荣,袁明.三疣梭子蟹牛奶病病原的分离鉴定[J].西北农林科技大学学报:自然科学版,2007,35(6):29-33.( 1) 1) |
| [11] | 陶保华,石和荣,黄俊文,等.假单胞菌引起罗氏沼虾黄鳃、黑鳃病的研究[J].中山大学学报:自然科学版,2000,39(21):255-259.( 1) 1) |
| [12] | 毛芝娟,王美珍,陈吉刚,等.黑鲷肠炎病原恶臭假单胞菌的分离和鉴定[J].渔业科学进展,2010,31(3):23-28.( 1) 1) |
| [13] | 刘家富,余柞溅,林永添,等.大黄鱼假单胞菌病的初步研究[J].海洋科学,2002,28(2):5-7.( 2) 2) |
| [14] | 任燕,刘鹏威.大黄鱼假单胞菌病病原的分离鉴定及药物敏感试验[J]. 广东农业科学,2012, (18): 151-154.( 2) 2) |
| [15] | 安树伟,袁思平,王国良.患诺卡氏菌病的大黄鱼几种主要组织的酶活力变化分析[J].渔业科学进展,2012,33(2):43-48.( 1) 1) |
| [16] | STACKEBRANDT, GOEBEL B M. Taxonomic note: A place for DNA-DNA reassociation and 16S rRNA sequence analysis in the present species definition in bacteriology[J]. Int J Syst Bact,1994,44:846-849.( 1) 1) |
 2015, Vol. 30
2015, Vol. 30
