文心兰Oncidium花形优美,花期长,是目前极具竞争力和发展潜力的一种高经济价值的花卉。但目前在文心兰上广泛存在病毒病危害,建兰花叶病毒(Cymbidium mosaic virus,CyMV)、齿兰环斑病毒(Odontoglossum ringspot virus,ORSV)和菜豆黄花叶病毒(Bean yellow mosaic virus,BYMV)是危害文心兰的常见病毒。病毒病的危害严重影响其观赏和利用价值,使植株表现出花叶、坏死、畸形、花瓣变色、花穗短小以及花期缩短等症状[1],使其品质严重下降,已成为制约文心兰产业发展的主要限制因素[2, 3]。目前国际上还没有防治植物病毒病的有效药剂,因此,有针对性地进行隔离检疫、销毁病株和培育无毒种苗等,是防控病毒病的重要措施。而这些都需要对种苗及植株进行病毒检测,建立快速有效地检测方法显得尤为重要。
目前,病毒检测的方法有以下几种:生物学方法[4]、电镜观察法[5]、酶联免疫法[1]、PCR 检测法[6, 7]等。 在文心兰中,国内外报道的侵染文心兰的病毒病有20多种,其中建兰花叶病毒和齿兰环斑病毒危害最严重。在文心兰的病毒检测中,多采用酶联免疫法[1, 8]和单重RT-PCR法[9, 10],应用多重RT-PCR法,主要集中在CyMV和ORSV这2种病毒[9, 11],迄今为止,未见应用多重RT-PCR方法检测文心兰多种病毒的研究。本研究建立了检测文心兰病毒的多重RT-PCR法,该方法一次反应能同时检测CyMV、ORSV和BYMV 3种病毒的多重RT-PCR法。该方法具有快速、准确、成本低、效率高等优点,能为生产提供有力技术支持。
1 材料与方法 1.1 样品采集及引物设计具有花叶、退绿、褐色斑等明显病毒病症状的文心兰病叶采自福建省农业科学院花卉中心种质资源圃。根据GenBank登录的CyMV、ORSV和BYMV 3种病毒 CP基因的保守序列设计3对引物(表 1)。
|
|
表 1 用于多重RT-PCR特异引物序列 Tab.1 Specific primers used in multiplex RT-PCR |
应用Trizol法,提取带病叶片的总RNA。应用PrimeScriptTM 1st Strand cDNA Synthesis Kit试剂盒(大连宝生物有限公司)合成cDNA第一链。
1.3 病毒样品的单重RT-PCR检测以上述反转录产物为模板,分别利用CyMV、ORSV和BYMV 3种病毒的特异性引物对病毒样品进行PCR扩增。单重PCR反应的体积为25 μL,其中包括2.5 μL 10×PCR buffer、2 μL dNTP 混合物(各2.5 mmol·L-1)、0.15 μL TaqDNA聚合酶(5 U·μL-1)、1 μL反转录产物作模板、1 μL上游引物(P1、P3或P5)(10 μmol·L-1)、1 μL下游引物(P2、P4或P6)(10 μmol·L-1),并以DEPC处理的H2O补足至25 μL。反应条件为:94℃预变性5 min; 94℃变性30 s,48~60℃退火30 s,72℃延伸45 s,共35个扩增循环;最后72℃延伸10 min。取5 μL PCR扩增产物进行琼脂糖凝胶电泳。通过单一PCR检测,筛选出同时含有3种病毒的样品用于多重PCR试验。
1.4 多重RT-PCR检测体系的建立在同一反应管中,加入含有3种病毒的cDNA模板 1 μL 和3种病毒特异引物各0.5 μL,其他反应体系及条件与单重RT-PCR 相同。
退火温度及引物浓度的探索:在有效的多重RT-PCR 条件下,考查多重PCR主要影响因素,考查某一影响因素时,其他因素不变。退火温度设48.0、51.0、54.0、56.0、58.0、60.0℃等6种处理;设IMMV、NLV 与BYMV 引物浓度分别1∶8∶4,1∶8∶8,1∶4∶8,1∶2∶1,1∶1∶1,2∶2∶1,4∶2∶1等7种比值,进行多重RT-PCR 体系的优化。
灵敏度检测:将含有3种病毒的样品 0.1 g,提取总RNA,按10-1倍进行浓度梯度稀释,取每个稀释后的样品1 μL 作为模板,按前述反应体系及反应条件进行灵敏度试验。
1.5 PCR产物的测序将PCR产物进行纯化,直接送上海生工生物工程公司进行序列测定。应用DNAMAN对所测序列进行比对分析。
1.6 田间样品检测随机采集6份带病毒症状的文心兰样品,提取总RNA,进行单重RT-PCR和多重RT-PCR检测,以验证其效果。
2 结果与分析 2.1 CyMV、ORSV 和BYMV单一RT-PCR检测体系的验证以健康文心兰叶片为阴性对照,提取带病文心兰叶片总RNA,分别利用引物P1/P2、P3/P4和P5/ P6 进行PCR扩增,由图 1看出,大小与设计预期相符,而在健康文心兰叶片中均未扩增出特异条带。为进一步验证所扩增出的核酸片段为目的病毒基因组序列,对所扩增的片段进行胶回收,并送上海生工测序,结果表明CyMV扩增片段为571 bp,ORSV扩增片段约为325 bp,BYMV 扩增片段约为212 bp,与预期大小相同。序列同源性分析结果表明,所得序列与参考序列的同源率分别达到99%、100%、100%。因此,表明本研究所设计的P1/P2、P3/P4和P5/ P6等3对引物,分别对文心兰中的CyMV、ORSV 和BYMV 检测具有很高的特异性。并筛选出同时含有3种病毒的样品用于多重RT-PCR体系的建立。
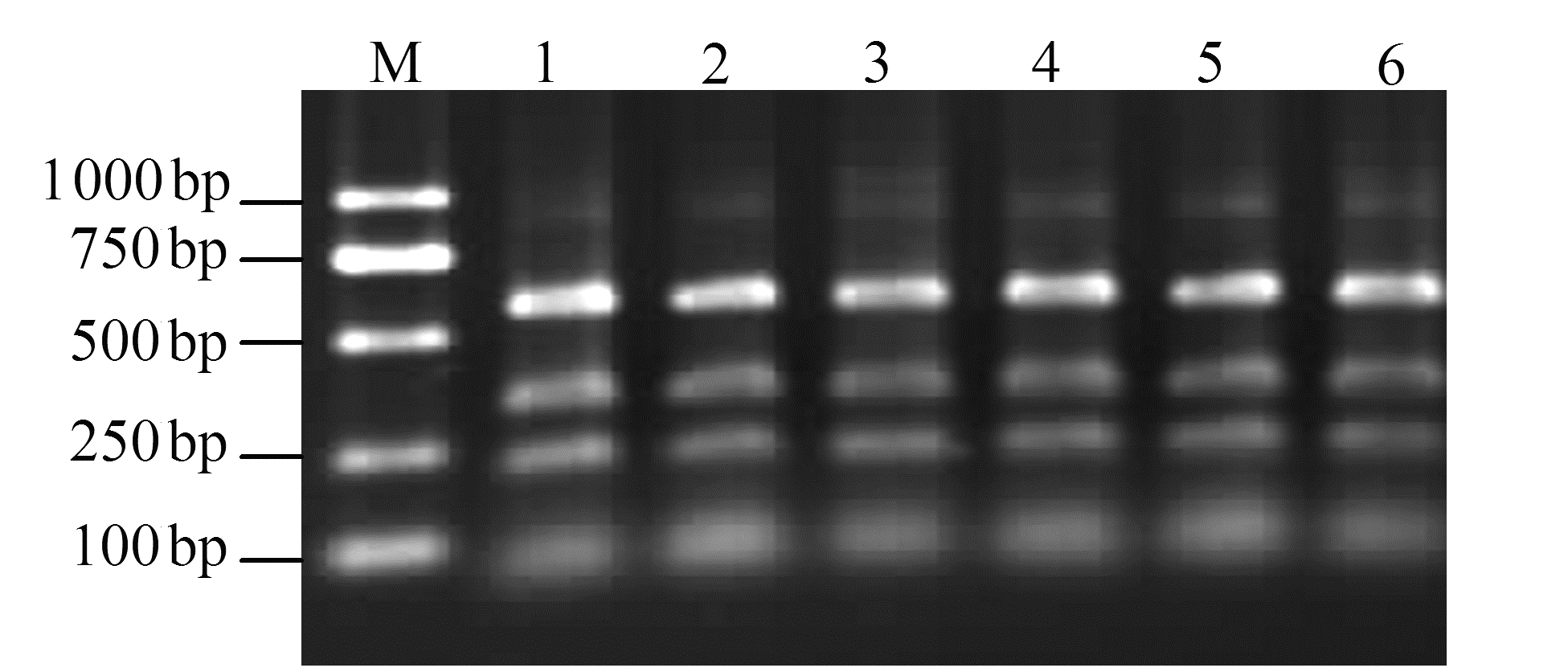
|
图 1 文心兰3个病毒的单重及多重RT-PCR Fig. 1 Individual and multiplex RT-PCR on 3 viruses in Oncidium 注:1为CyMV; 2为ORSV; 3为BYMV; 4为CyMV、ORSV与BYMV,5为阴性对照,M为DNA标准。 |
由图 2可以看出,CyMV、ORSV与BYMV 在48~60℃间都有3条明亮的扩增条带,又根据退火温度越高特异性越强的原理,认为3种病毒多重RT-PCR 反应的最佳退火温度为60℃。由图 3 可以看出,CyMV、ORSV与BYMV等6 种引物浓度比值均可扩增得到对应条带,但当比值为1∶8∶8时,3种病毒特异条带更明亮一些,多重PCR 反应的最佳引物浓度比值为1∶8∶8。
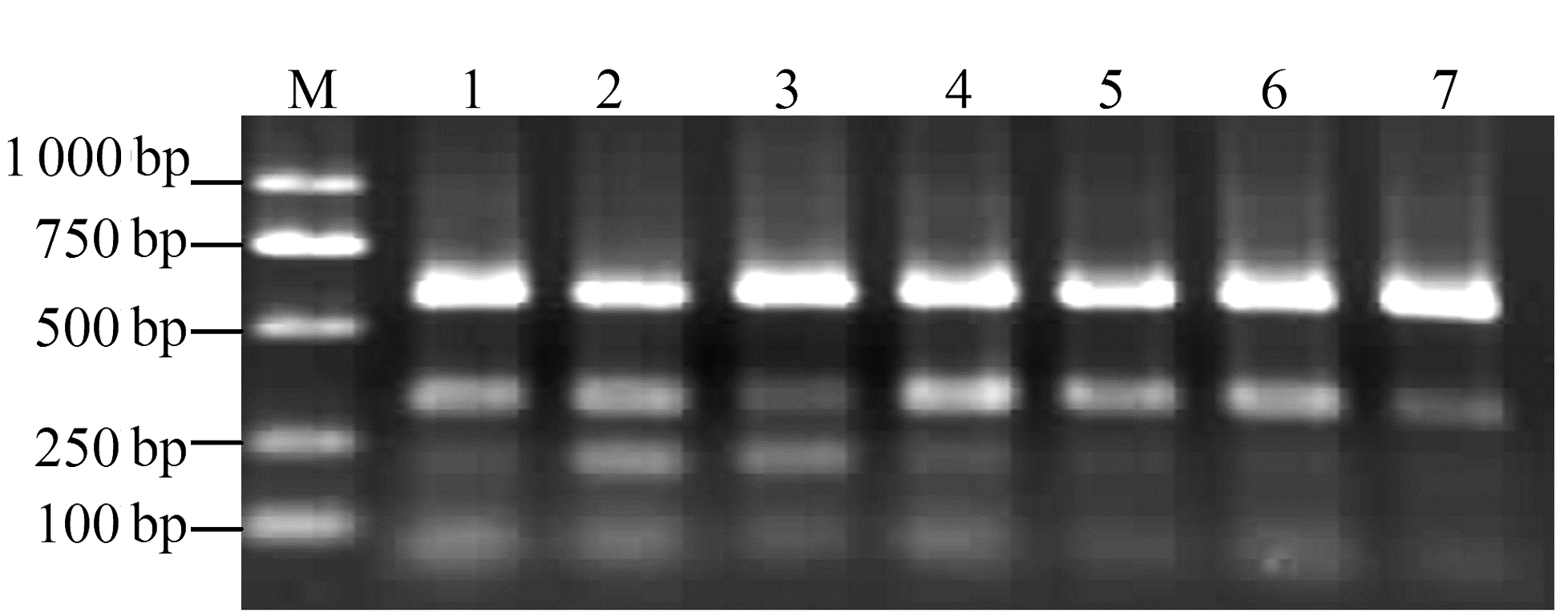
|
图 2 不同退火温度多重RT-PCR扩增结果 Fig. 2 Multiplex RT-PCR products obtained from various annealing temperatures 注:M为 DNA标准; 1~6为退火温度分别为48、51、54、56、58、60℃。 |
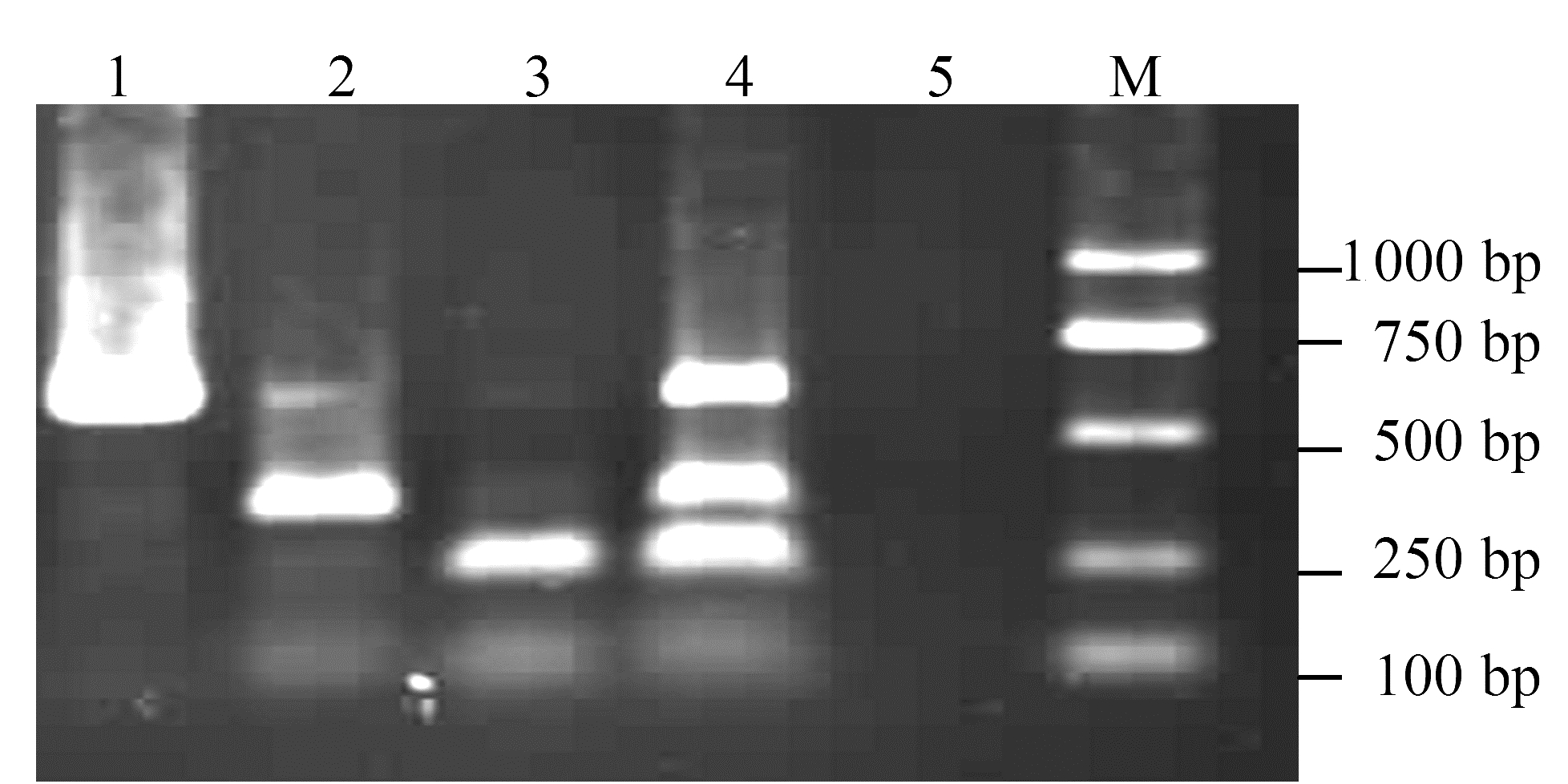
|
图 3 不同引物浓度多重RT-PCR扩增结果 Fig. 3 Multiplex RT-PCR products obtained from different concentrations of primer 注:M为DNA marker; 1~7为CyMV、ORSV与BYMV引物浓度比例分别为1∶8∶4,1∶8∶8,1∶4∶8,1∶2∶1,1∶1∶1,2∶2∶1,4∶2∶1。 |
综上所述,最终将多重PCR反应体系设为(25 μL): 0.15 μL 5 U·μL-1的Taq酶、2.5 μL的10×Taq酶buffer、2 μL 2.5 mmol·L-1的dNTPs、1 μL模板、0.04 μmol·L-1的CyMV正反向引物、0.32 μmol·L-1的ORSV正反向引物、0.32 μmol·L-1的BYMV正反向引物,灭菌双蒸水补至25 μL。
2.3 多重RT-PCR 体系灵敏度检测将提取的总RNA 进行系列浓度梯度稀释后,采用所建立的多重RT-PCR体系对3种病毒进行灵敏度检测试验,结果表明(图 4),ORSV和BYMV在样品浓度10-4倍稀释后仍能扩增出特异条带,10-5倍稀释后条带非常微弱;CyMV在样品10-2倍稀释后仍能扩增出清晰的特异条带,10-3 倍稀释后扩增条带很微弱。这些结果表明,不同病毒可能由于在植株中含量不同,而导致其检测灵敏度不同。
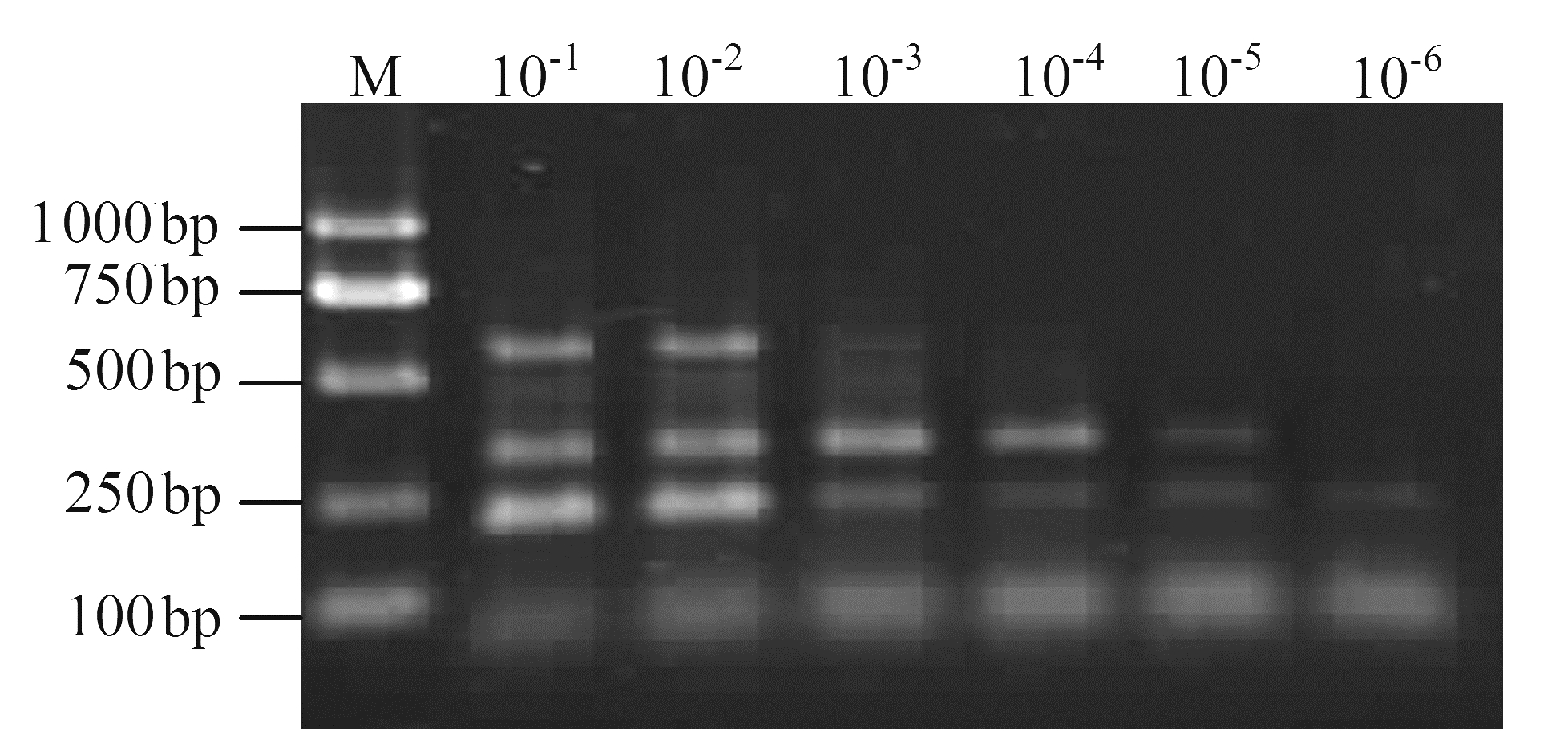
|
图 4 文心兰3种病毒多重RT-PCR法检测灵敏度 Fig. 4 Sensitivity analysis on detection of 3 Oncidium viruses with multiplex RT-PCR |
随机采取田间样品8份,采用单重RT-PCR进行检测,样品1、6、7、8携带CyMV病毒,样品2、3、4携带CyMV、ORSV、BYMV这3种病毒,样品5携带CyMV、 BYMV这2种病毒。利用所建立的多重RT-PCR 检测技术对8份已知带病样品进行检测。结果显示,多重RT-PCR检测结果与已知各样品单一RT-PCR检测结果一致(图 5)。

|
图 5 文心兰田间发病样品的多重RT-PCR 检测电泳结果 Fig. 5 Results of Multiplex RT-PCR detection on field samples of Oncidium 注:M为DNA 分子标准;1~8为文心兰田间发病样品检测结果。 |
目前文心兰主要通过组培快繁进行大量繁殖,而病毒病的危害是制约其产业发展的主要因素,因此,在进行组培快繁时,要对种苗进行病毒检测,以防止病毒大面积扩散。本研究中建立的这3种多重RT-PCR检测方法,可以快速准确、简便经济地检测出带毒情况,对控制病害的发生,抗病筛选和病害流行预测具有重要的意义。
多重RT-PCR要求在同一反应体系中进行多个位点的特异性扩增,研究发现,引物设计是多重RT-PCR非常关键的一步。对CyMV、ORSV和BYMV 3种病毒的引物设计,在NCBI中已登录的这3种病毒的所有CP基因序列,包括全基因组序列和部分CP基因序列,力争设计引物能够检测到这3种病毒的所有株系和基因型,另外,为减少引物二聚体的存在,通过DNAMAN比对调整引物,使各条引物之间尽量不存在互补,此外,设计引物时使各对引物的Tm 值相近,以确保在同一退火温度下可以同时扩增CyMV、ORSV和BYMV这3种病毒。
| [1] | HU J S, FERREIRA D, WANG M, et al. Detection of cymbidium mosaic virus, odontoglossum ringspot virus, tomato spotted wilt virus, and potyviruses infecting orchids in Hawaii[J]. Plant Disease, 1993, (77): 464-468.( 3) 3) |
| [2] | ZETTLER F W, KO N J, WISLER G C, et al. Viruses of orchids and their control[J]. Plant Disease, 1990, 74(9): 621-626.( 1) 1) |
| [3] | WONG S M, CHENG C G, LEE Y H, et al. Incidence of cymbidium mosaic and odontoglossum ringspot viruses and their significance in orchid cultivation in Singapore[J]. Crop Protection, 1994, 13: 235-239.( 1) 1) |
| [4] | 尤毅,鄢慧琼,李华平,等. 冬瓜人工接种5种病毒后的症状观察[J]. 中国蔬菜, 2009,(22): 58-62.( 1) 1) |
| [5] | RUBIES AUTONELL C,BALLANTE M, TURINA M. Viral infections in melon crops of cenral northem Italy[J]. Informatore Fitopatologieo, 1999, 46: 6-10.( 1) 1) |
| [6] | MENZEL W, JELKMANN W, MAISS E. Detection of four apple viruses by multiplex RT-PCR assays with coamplification of plant mRNA as internal control[J]. Journal of Virological Methods, 2002, 99: 81-92.( 1) 1) |
| [7] | THOMPSON J R, WETZEL S, KLERKS M M, et al. Multiplex RT-PCR detection of four aphid-borne strawberry viruses in Fragaria spp. in combination with a plant mRNA specific internal control[J]. Journal of Virological Methods, 2003, 111(2): 85-93.( 1) 1) |
| [8] | 郑平, 刘荣维, 徐明全, 等. 国内两种主要兰花病毒病的综合普查研究[J]. 广东农业科学,2001,(6): 37-40.( 1) 1) |
| [9] | 周国辉, 陈晓琴, 周洁浪, 等. 广东省兰花建兰花叶病毒分子鉴定及其外壳蛋白基因序列分析[J]. 华中农业大学学报, 2004, 23(4): 381-384.( 1) 1) |
| [10] | 张巧萍, 丁元明, 李旻,等. 盆栽文心兰上的凤仙花坏死斑病毒的检测与分子鉴定[J]. 植物检疫, 2008, 22(6): 348-351.( 1) 1) |
| [11] | 章鹏程,陈芝娟,杨科府,等. 一步式IC-RT-PCR同时检测2种兰花病毒的探讨[J]. 浙江农业科学, 2012,(8): 1165-1168.( 1) 1) |
 2015, Vol. 30
2015, Vol. 30
