2. 福建省农业科学院畜牧兽医研究所, 福建 福州 350013
2. Institute of Animal Husbandry and Veterinary Medicine, Fujian Academy of Agricultural Sciences, Fuzhou, Fujian 350013, China
禽流感是由禽流感病毒(avian influenza virus,AIV)引起的禽类全身性或呼吸性的疾病综合症[1],根据其致病性可分为高致病性和低致病性2类[2]。H5N1亚型禽流感病毒引起鸭群的暴发性死亡,而H9N2亚型禽流感病毒为低致病性禽流感病毒,并不导致感染家禽大批死亡,只引起家禽轻微的呼吸道症状,产蛋鸡产蛋量下降等[3]。但H9N2亚型禽流感病毒传播广泛,病毒有可能通过水禽的粪便排出而污染水源及其饲养场所,使水禽成为重要的传播媒介,导致病原的流行性发生[4, 5]。鸭坦布苏病毒病(Duck Tembusu Virus Disease,DTVD)是由鸭坦布苏病毒(Duck Tembusu Virus,DTMUV)引起的一种急性传染病[6]。该病以高热、产蛋量骤降甚至停产和卵泡出血为主要特征,病程可长达数周[7, 8, 9, 10, 11]。随着我国养鸭业的迅速发展,鸭禽流感及鸭坦布苏病已成为危害养鸭业发展的重要传染病,而且是常发病,及时准确地诊断对控制这些传染病具有非常重要的意义。目前禽流感的诊断方法主要有血凝试验、血凝抑制试验(HA、HI)、酶联免疫吸附试验(ELISA)、免疫荧光试验、琼脂扩散试验(AGP)、病毒中和试验等,但这些方法在灵敏度、特异性、时效性、易用性、稳定性等方面存在一定的缺陷[12]。坦布苏病毒的诊断目前主要靠病毒的分离,也有一些分子生物学的方法,但还不够成熟,常会造成误诊,给养殖户造成较大损失。临床上由于坦布苏病毒感染与禽流感病毒感染常常难以区分,或者混合感染,而且禽流感病毒还有亚型的区分,因此需要对2种甚至2种以上的病毒同时进行检测,但目前的方法一次试验只能检测1种病毒,如需检测多种病毒要做多次检测,不仅费时费力,还可能造成误诊。因此,本试验旨在通过一次检测,可同时区分鸭坦布苏病毒、禽流感病毒的单一或混合感染,为及时控制疫病提供有效检测方法。
1 材料与方法 1.1 试验材料 1.1.1 病毒株H5亚型AIV、H9 亚型AIV、鸭坦布苏毒株(DTMUV)均由福建省农业科学院畜牧兽医研究所禽病研究室提供;鸭肝炎病毒、鸭瘟病毒、鸭圆环病毒、鸭副黏病毒、番鸭细小病毒、番鸭呼肠孤病毒等由华南农业大学禽病重点实验室提供。
1.1.2 主要试剂RNA提取试剂购自TIANGEN公司;HiFiScript cDNA第一链合成试剂盒购于康为试剂公司;DNA聚合酶和RNA酶抑制剂购自北京全式金生物技术有限公司;DL2000 DNA Marker购自英特生物有限公司。
1.1.3 主要仪器美国BIO-RAD公司生产的C1000PCR仪、德国HERMLE公司生产的低温高速离心机、北京六一仪器厂生产的DYY-6C型电泳仪、美国BIO-RAD公司生产的凝胶成像系统、海尔-80℃超低温冰箱等、Quawell 公司生产的UV-Vis Spectrophotometer Q5000微量分光光度计等。
1.2 试验方法 1.2.1 引物设计与合成根据GenBank已发表的DTMUV NS5 基因、H5亚型与H9亚型 AIV HA 基因的保守核苷酸序列,用 DNA STAR和OLIGO 6.0 软件分别设计针对3种鸭病原的扩增引物,经BLAST进行特异性比对验证,分别获得3对特异性引物(表 1)。引物由北京奥科鼎盛生物科技有限公司合成,置-20℃保存备用。
|
|
表 1 引物序列信息 Tab.1 Sequences of primers |
利用TIANamp Virus RNA Kit(离心柱型病毒RNA提取试剂盒)提取病毒RNA,用HiFiScript cDNA第一链合成试剂盒进行反转录:采用20 μL体系,于EP 管中依次加入 Primer Mix 2 μL、2.5 mmol·L-1 dNTP 4 μL、RNA模板4 μL、无RNA 酶的灭菌水2 μL,总体积共12 μL,70℃孵育10 min,迅速冰浴2 min。短暂离心,使管壁上的溶液收集到管底。继续向以上反应液中加入5×RT Buffer 4 μL、0.1 mmol·L-1 DDT 2 μL,RNA酶抑制剂1 μL,轻轻吹打混匀,42℃孵育2 min。加入1 μL HiFiScript(200 μ·μL-1),轻轻吹打混匀,42℃孵育50 min,85℃孵育5 min。反应结束后,短暂离心,置于冰上冷却或将制备的 cDNA置-20℃ 保存备用。
1.2.3 多重PCR反应的建立多重PCR发应在25 μL反应体系中进行:10×buffer (2.5 μmoL·L-1) 2 μL,MgCl2(25 mmoL·L-1) 2 μL,dNTPs 2 μL,DTMUV、H5亚型AIV、H9亚型AIV上下游引物各0.5 μL,DTMUV、H5亚型AIV、H9亚型AIV基因组DNA各2 μL,Taq酶(5 U·μL-1) 0.5 μL,加dd H2O 至总体积为25 μL。对DTMUV 引物、H5亚型AIV 引物、H9亚型AIV引物用量进行优化,对终浓度组合(组合中H5亚型AIV、H9亚型AIV和DTMUV的引物对终浓度组合设置如下(0.5、0.5、0.5;0.5、1.0、0.5;0.5、1.0、1.0;1.0、0.5、0.5;1.0、1.0、1.0 μmol·L-1)反应条件进行优化,多次重复后确定引物最佳反应用量。将退火温度按50~60℃依次递增,多次重复后确定最佳退火温度,筛选出多重PCR最佳反应条件。将扩增获得的3种病原的目的片段经切胶回收纯化后,送上海生工生物技术公司进行测序,获得的测序结果经BLAST比对分析,确定所扩增序列的正确性。
1.2.4 多重PCR特异性试验采用优化后的扩增条件,以DTMUV、H5亚型AIV、H9亚型AIV、鸭新城疫病毒、鸭肝炎病毒、番鸭呼肠孤病毒的cDNA和番鸭细小病毒、鸭圆环病毒、鸭瘟病毒的DNA作为待测样品进行检测,并以无菌水作为阴性对照,检测三重PCR特异性。
1.2.5 多重PCR的敏感性试验将提取的DTMUV、H5亚型AIV、H9亚型AIV 3种病毒RNA,用UV-Vis Spectrophotometer Q5000微量分光光度计测定其浓度,并按10倍递增稀释,各取1 μL,按照上述优化的PCR反应条件进行PCR检测,以其模板最高稀释倍数扩增呈阳性为其PCR的敏感度。
1.2.6 临床样品的检测2014-2015年,于江西南昌、丰城、南丰、地区鸭群收集200份临床病料,采集肝脏、胰、脾等组织,与生理盐水按照1∶3的比例进行研磨后离心,使用TIANamp Virus RNA Kit(离心柱型病毒RNA提取试剂盒)提取病毒RNA,按优化后的多重PCR程序进行反应,计算阳性率。
2 结果与分析 2.1 多重PCR反应的建立多重PCR反应条件为总体积20 μL:10×buffer (2.5 μmoL·L-1) 2 μL,MgCl2 (25 mmoL·L-1) 2 μL,dNTPs 2 μL,DTMUV、H5亚型AIV、H9亚型AIV上下游引物各0.5 μL,DTMUV、H5亚型AIV、H9亚型AIV基因组DNA各2 μL,Taq酶(5 U·μL-1) 0.5 μL,加灭菌水至总体积为20 μL。经GenBank数据库的BLAST比对分析表明,所获得的3个扩增片段均为相应病毒的基因序列,且与预期的扩增条带大小一致。
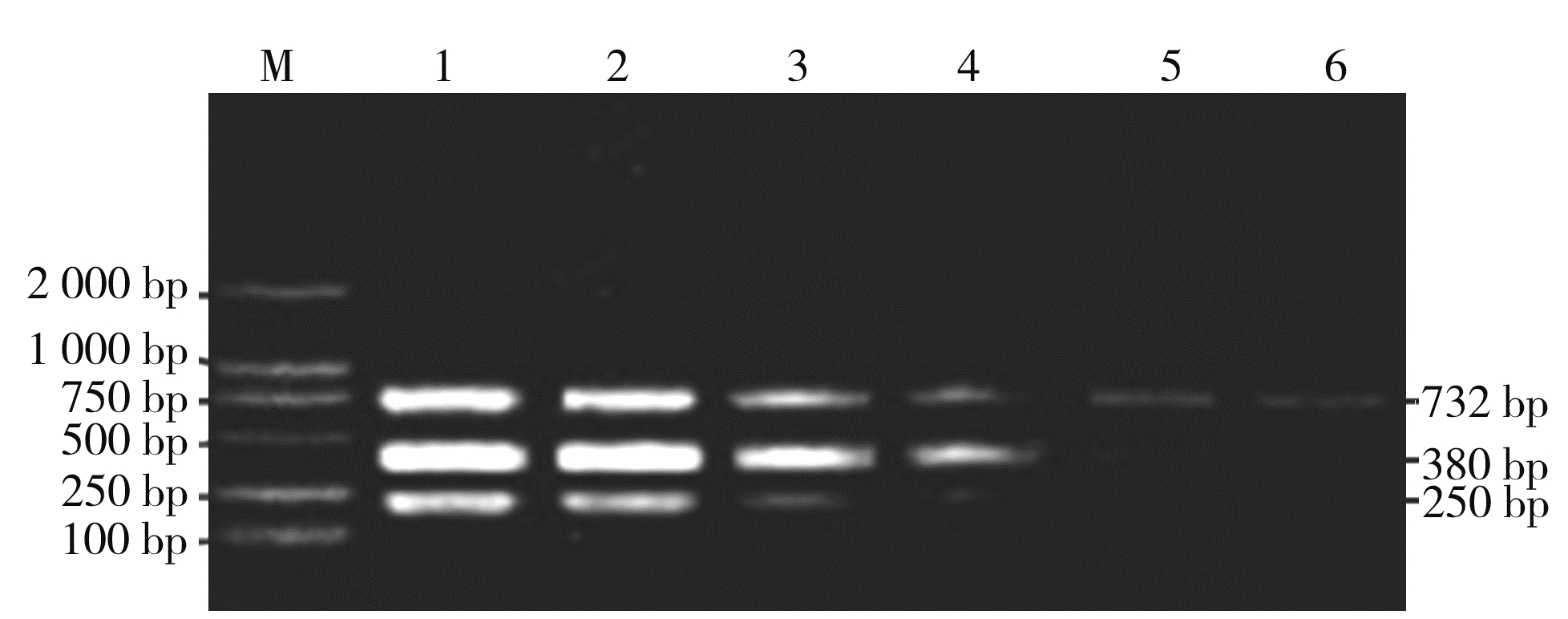
2.2 特异性试验对含有DTMUV、H5亚型AIV、H9亚型AIV的核酸样品进行检测,均能扩增出与预期相符的250、380、732 bp条带,而其他鸭病病原体在相同位置并未出现特异性条带,说明该方法具有良好的特异性(图 1)。

|
图 1 三重PCR特异性试验 Fig. 1 Specificity test of the triplex PCR 注:M为100 bp DNA ladder; 1为鸭坦布苏病毒+H9 亚型AIV+ H5 亚型AIV; 2为H9亚型AIV; 3为H5亚型 AIV;4为鸭坦布苏病毒; 5为番鸭呼肠孤病毒; 6为番鸭细小病毒;7为鸭圆环病毒; 8为鸭新城疫病毒; 9为鸭肝炎病毒;10为鸭瘟病毒; 11为阴性对照。 |
用UV-Vis Spectrophotometer Q5000微量分光光度计测得DTMUV、H5亚型AIV、H9亚型AIV的RNA分别为660 ng·μL-1、533 ng·μL-1、560 ng·μL-1,应用优化后的多重PCR方法对10倍梯度稀释的混合RNA进行检测,结果表明,该多重PCR对DTMUV、H5亚型AIV、H9亚型AIV的检测极限分别为6.6 ng·μL-1、533 pg·μL-1、56 pg·μL-1(图 2)。
|
图 2 三重PCR敏感性试验 Fig. 2 Sensitivity test of the triplex PCR 注:M为100 bp DNA ladder;1为 660 ng·μL-1DTMUV,533 ng·μL-1 H5,560 ng·μL-1 H9;2为66 ng·μL-1LDTMUV,53.3 ng·μL-1L H5,56 ng·μL-1 H9;3为6.6 ng·μL-1DTMUV,5.33 ng·μL-1 H5,5.6 ng·μL-1 H9;4为660 pg·μL-1LDTMUV,533 pg·μL-1 H5,560 pg·μL-1 H9;5为66 pg·μL-1DTMUV,53.3 pg·μL-1 H5,56 pg·μL-1 H9;6为6.6 pg·μL-1DTMUV,5.33 pg·μL-1 H5,5.6 pg·μL-1 H9。 |
利用建立的多重PCR方法,对2014-2015年江西南昌、丰城、南丰、地区鸭群收集的200份临床病料进行检测,结果(图 3)检测出DTMUV 7份(阳性率为3.5%),H5亚型AIV 9份(阳性率为4.5%),H9亚型AIV 4份(阳性率为2%)。

|
图 3 三重RT-PCR临床样品部分检测结果 Fig. 3 Detection results of clinical samples using the triplex PCR 注:M为100 bp DNA ladder;1,3,6,7,8为H5亚型AIV阳性病料; 2为H9亚型AIV阳性病料; 4,5为H5亚型AIV与 H9亚型AIV阳性混合病料。 |
DTMUV和AIV的2种亚型均是当今危害养鸭业发展的主要病原体,常呈混合感染。这3种病毒对养鸭业危害较大。禽流感病毒和坦布苏病毒均能感染蛋鸡、鸭和鹅,并导致产蛋下降,在开产(蛋)鸡、开产种(蛋)鸭、肉用鸭发生坦布苏病毒时,都应注意与禽流感病毒的鉴别诊断。因此,快速并且同时检测这3种病原具有重要的临床意义。
虽然鸭坦布苏病毒及禽流感病毒都已经有RT-PCR的检测方法,但是同时检测3种病毒的诊断方法还未报道。本研究建立的多重PCR方法能够用于DTMUV、H5亚型AIV、H9亚型AIV的单纯感染和混合感染检测。多重PCR反应条件的优化是多重PCR成功的关键,比常规PCR复杂得多[13],考虑到多重PCR反应引物之间容易产生干扰,本研究设计的引物的目的片段的大小有合适的梯度(DTMUV为250 bp,H5亚型AIV为380 bp,H9亚型AIV为732 bp),引物退火条件尽可能相近(DTMUV为53℃,H5亚型AIV为53.6℃,H9亚型AIV为54.1℃),引物用量均为0.5 μL(0.5 μmol·L-1)。多重PCR的优点主要体现在能同时检测的基因数目增多及反应的敏感性、特异性等方面[14]。通过特异性和敏感性试验,发现本试验构建的多重RT-PCR能够特异性扩增出H5亚型AIV、H9亚型AIV 和DTMUV等3种病原,对鸭的其他病原不敏感,特异性良好;能同时检出6.6 ng·μL-1的DTMUV、533 pg·μL-1的H5亚型AIV、56 pg·μL-1 的H9亚型AIV,具有较高的敏感性,能满足3种病原的临床检测要求,适用于大批量检测,为及时控制疫病提供有效方法。
| [1] | BW卡尔克. 禽病学[M]. 高福,苏敬良,译.第9版.北京:北京农业大学出版社,1991:455-471.( 1) 1) |
| [2] | 赵虹,谢芝勋,谢丽基,等.鸭坦布苏病毒和禽流感病毒多重 PCR 检测方法的建立[J].畜牧与兽医,2015,47(3):90-93.( 1) 1) |
| [3] | 唐秀英,付朝阳,冯菊艳.H9亚型禽流感的流行与防制[J].预防兽医学进展,2000,2(4): 1-3.( 1) 1) |
| [4] | ALEXANDER D J. An overview of the epidemiology of avian influenza[J].Vaccine, 2006,(10): 1016-1051.( 1) 1) |
| [5] | BANO S, NAEEM K, MALIK S A. Evaluation of pathogenic potential of avian influenza viruses serotype H9N2 in chickens[J].Avian Diseases, 2003,47(3):817-822.( 1) 1) |
| [6] | 陈桂英. 鸭坦布苏病毒病诊断方法概述[J]. 动物医学进展,2013,34(8):107-111.( 1) 1) |
| [7] | 曹贞贞,张存,黄瑜,等.鸭出血性卵巢炎的初步研究[J].中国兽医杂志,2010,46(12):3-6.( 1) 1) |
| [8] | 万春和,施少华,程龙飞,等.一种引起种(蛋)鸭产蛋骤降新病毒的分离与初步鉴定[J]. 福建农业学报,2010,25(6):663-666.( 1) 1) |
| [9] | 滕巧泱,颜丕熙,张旭,等.新的黄病毒导致蛋鸭产蛋下降及死亡[J].动物传染病学报,2010,18(6):1-4.( 1) 1) |
| [10] | 黄瑜,苏荣茂,傅光华,等.禽坦布苏病毒感染的宿主及临床表现[J].中国兽医杂志,2014,50(11):50-52.( 1) 1) |
| [11] | 刘友生,彭春香,傅光华,等.2010-2011 年中国部分地区禽坦布苏病毒感染调查及分子变异分析[J].中国动物传染病学报,2012,20(1):47-53.( 1) 1) |
| [12] | 曾婷婷,谢芝勋,谢丽基,等.4株广西鸭源坦布苏病毒分离及初步鉴定[J].中国动物检疫,2013,(6): 31-35.( 1) 1) |
| [13] | 许宗丽,谢芝勋,谢丽基,等.鸭新城疫病毒和鸭圆环病毒二重PCR 检测方法的建立[J]. 中国动物检疫,2012,29(5):34-37.( 1) 1) |
| [14] | 黄溢泓,陈强,韦正吉,等.多重PCR同时检测鸡AIV、NDV、IBV、ILTV和MG方法的建立和临床应用[J]. 广西农业科学,2009,40(6):759-763.( 1) 1) |
 2015, Vol. 30
2015, Vol. 30
