2. 福建省海洋生物增养殖与高值化利用重点实验室, 福建 厦门 361013
2. Key Laboratory of Cultivation and High-value Utilization of Marine Organisms in Fujian Province, Xiamen, Fujian 361013, China
硫酸软骨素(Chondroitin Sulfate,简称CS)以蛋白多糖形式存在于软骨组织中,其中CS多糖与核心蛋白通过共价键(糖肽键)连接形成蛋白聚糖[1],而蛋白聚糖间则通过盐键、氢键连接[2],因此,要从软骨组织中提取CS仅依靠破坏盐键、氢键这2个次级键是不够的,而须通过破坏糖肽键来降解蛋白质,方能有效地提取并获得较高纯度的CS[3]。碱液浸提法可促使糖蛋白发生β-消去反应,通过破坏多糖链与核心蛋白间的共价键,使得CS能从蛋白多糖中以游离态释放出来[4]。该过程虽可显著提高CS得率,但因鱿鱼软骨中的胶原蛋白、粘蛋白在碱性条件下无法完全水解,且在弱酸性或中性条件下为可溶状态,不易被剔除,从而影响了CS的提取率[5]。蛋白质的存在是产品中最主要的杂质之一,因此提高产物的得率和CS含量关键在于去除杂质蛋白。木瓜蛋白酶具有广泛的底物特异性,对蛋白有较强的水解能力,可通过裂解精氨酸、赖氨酸、谷氨酸和苯丙氨酸等氨基酸形成的,将杂质蛋白水解成醇溶性的氨基酸或短肽[6, 7],从而使蛋白质从CS多糖中剥离,进而提高产品的纯度。酶解法提取CS反应条件温和,CS结构不易发生降解,有利于保持其生物活性,因此,本试验选用木瓜蛋白酶进行酶解提取制备CS,以蛋白质含量、硫酸软骨素含量为评价指标,采用正交组合设计进行优化试验,探讨在碱液浸提基础上酶解法的最佳工艺参数。
1 材料与方法 1.1 材料与试剂试验材料:鱿鱼软骨,福建晋江闽南水产开发有限公司提供。
试验试剂:牛血清白蛋白,厦门泰京生物技术有限公司;木瓜蛋白酶(80万U·g-1),无锡市雪梅酶制剂科技有限公司;硫酸软骨素标准品,SIGMA公司;间苯三酚(分析纯),天津市光复精细化工研究所;氢氧化钠(食品级)、盐酸(食品级),广东光华科技股份有限公司;磷酸、冰醋酸、无水乙醇、活性炭、考马斯亮蓝G-250等均为市售分析纯。
1.2 仪器与设备BS2202S电子天平,赛多利斯(Sartorius)科学仪器(北京)有限公司;pB-10 pH计,赛多利斯(Sartorius)科学仪器(北京)有限公司;DKB-501A型超级电热恒温水浴锅,上海精宏实验设备有限公司;Eppendorf 5804R冷冻离心机,艾本德中国有限公司;R205旋转蒸发器,上海申生科技有限公司;SHZ-D(Ⅲ)循环水式真空泵,巩义市予华仪器有限责任公司;SCIENTZ-10N 冷冻干燥机,宁波新芝生物科技股份有限公司;XW-80A 旋涡混合仪,海门市其林贝尔仪器制造有限公司;UV-3200 紫外可见分光光度计,上海美谱达仪器有限公司。
1.3 试验方法 1.3.1 工艺流程鱿鱼软骨经碱处理后,取适量碱浸提液[8]调节pH,加入一定比例木瓜蛋白酶,恒温酶解数小时,经高温灭活后,加入活性炭保温吸附20 min,减压浓缩,真空冷冻干燥得CS粉末。CS酶解工艺流程如图 1所示:
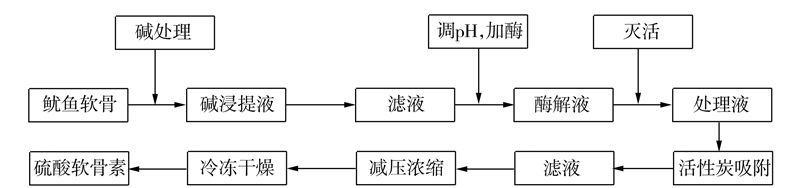
|
图 1 酶解工艺流程 Fig.1 Flow chart on enzymatic hydrolysis process |
(1)蛋白质含量的测定[9]: 考马斯亮蓝G-250的配制:精确称取0.1 g考马斯亮蓝G-250溶于50 mL 95%乙醇中,再加入85%磷酸100 mL,转移至1 000 mL容量瓶中加蒸馏水定容,用快速中性滤纸抽滤后置于棕色瓶中保存。
蛋白标准溶液的配制:精确称取10 mg牛血清蛋白,用蒸馏水溶解并定容至100 mL,即得0.1 mg·mL-1蛋白质标准液,置于4℃下保存。
标准曲线的制作:分别吸取蛋白质标准液0、0.2、0.4、0.6、0.8、1 mL于10 mL刻度试管中,各管加水稀释至1 mL,加入5 mL考马斯亮蓝G-250,漩涡混匀,室温静置10 min,以试剂空白为参比,于595 nm波长处测定其吸光度,并绘制标准曲线(如图 2)。
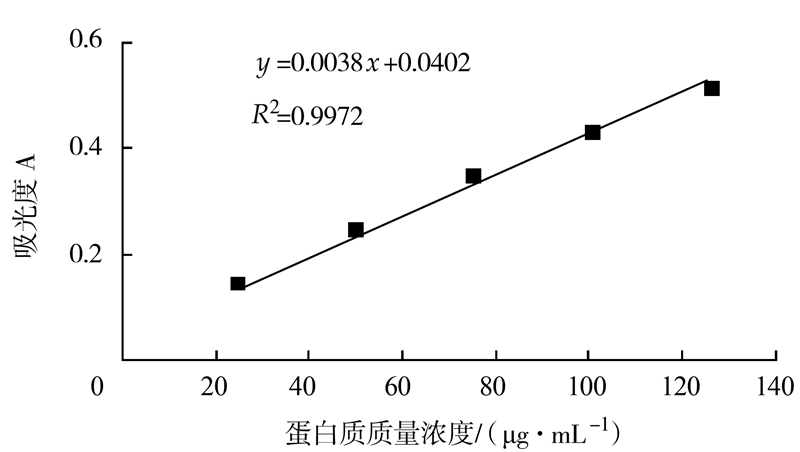
|
图 2 蛋白质标准曲线 Fig.2 Standard curve for protein content determination |
样品的测定:称取适量样品加水溶解并稀释至一定浓度,取1 mL,加入5 mL考马斯亮蓝G-250,漩涡混匀,静置10 min后,于595 nm处测定吸光度,根据标准曲线计算样品蛋白质含量。
(2)硫酸软骨素含量的测定[10]: 间苯三酚试液的配制:取50 mg·mL-1间苯三酚乙醇溶液10 mL,加入冰醋酸30 mL、盐酸40 mL,混匀即为反应试剂(临用前配制)。
硫酸软骨素标准溶液的配制:精确称取经105℃干燥至恒重的硫酸软骨素50 mg于50 mL容量瓶中定容,即为1 mg·mL-1硫酸软骨素标准液。
标准曲线的制作:分别吸取硫酸软骨素标准液0、0.2、0.4、0.6、0.8、1 mL于25 mL具塞试管中,各管加水稀释至1 mL,加入3 mL间苯三酚试液,塞盖混匀,置于沸水浴中加热30 min后取出,迅速冰浴冷却至室温,加入6 mL冰醋酸,混匀,以试剂空白为参比,于445 nm波长处测定其吸光度,并绘制标准曲线(图 3)。
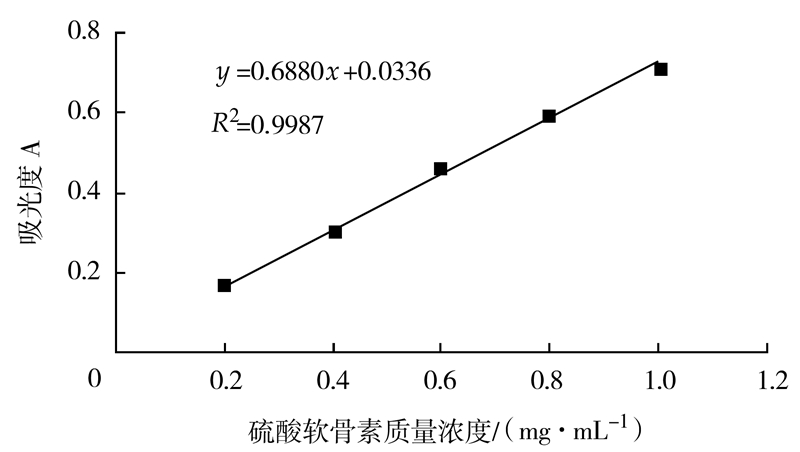
|
图 3 硫酸软骨素标准曲线 Fig.3 Standard curve for chondroitin sulfatecontent determination |
样品的测定:称取适量样品加水溶解并稀释至一定浓度,取1 mL,加入3 mL间苯三酚试液,塞盖混匀,置于沸水浴中加热30 min后取出,迅速冰浴冷却至室温,加入6 mL冰醋酸,混匀,于445 nm波长处测定其吸光度,根据标准曲线计算样品硫酸软骨素含量。
1.3.3 酶解法单因素试验(1)pH(只考虑反应初始值): 取一定量的鱿鱼软骨碱提液,加入2%木瓜蛋白酶,控制酶解温度55℃,固定酶解时间6 h,分别将pH值调节为5、5.5、6、6.5、7、7.5,探讨不同pH对硫酸软骨素提取质量的影响。
(2)酶添加量: 取一定量的鱿鱼软骨碱提液,调节pH至6.5左右,控制酶解温度55℃,固定酶解时间6 h,分别加入木瓜蛋白酶(W/V)1%、1.5%、2%、2.5%、3%,探讨不同酶添加量对硫酸软骨素提取质量的影响。
(3)酶解温度: 取一定量的鱿鱼软骨碱提液,调节pH至6.5左右,加入2%木瓜蛋白酶,固定酶解时间6 h,分别将酶解温度控制为45、50、55、60、65、70℃,探讨不同酶解温度对硫酸软骨素提取质量的影响。
(4)酶解时间: 取一定量的鱿鱼软骨碱提液,调节pH至6.5左右,加入2%木瓜蛋白酶,控制酶解温度55℃,分别将酶解时间设置为2、3、4、5、6、7、8 h,探讨不同酶解时间对硫酸软骨素提取质量的影响。
1.3.4 酶解法正交试验在单因素试验的基础上,采用正交组合设计方法对酶解工艺条件进行优化试验,固定酶添加量为2%,选取pH、酶解温度、酶解时间3个因素作为试验因素,以蛋白质含量和硫酸软骨素含量作为评价指标,设计三因素三水平L9(34)正交试验,确定最佳酶解工艺参数,酶解试验因素水平见表 1。
| 表 1 正交试验因素水平表 Table 1 Factors and levels of orthogonal experiment |
pH对酶活力和酶解速率有一定的影响(图 4),本试验选用的木瓜蛋白酶最适pH为5.5~7.0,因此选取pH值5.0~7.5,分析其对硫酸软骨素提取质量的影响。
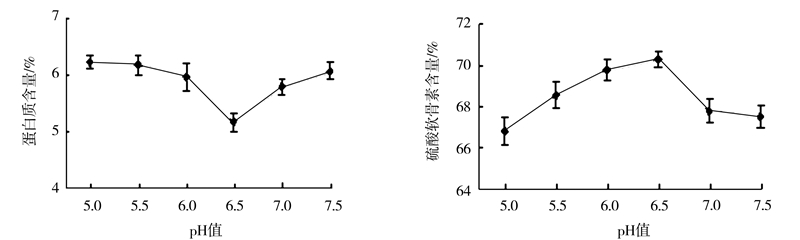
|
图 4 pH对硫酸软骨素提取质量的影响 Fig.4 Effect of pH on extraction of chondroitin sulfate from squid cartilage |
由图 4可以看出,随着pH的升高,产物中的蛋白质含量先减小后增加,在pH为6.5左右时蛋白质含量达到最小,为5.17%,与此同时,硫酸软骨素含量随着pH的升高呈上升趋势,当pH为6.5时硫酸软骨素含量达到最大,为70.3%,继续升高pH时,硫酸软骨素含量则呈下降趋势。这是因为酶和蛋白质分子中某些特定基团的解离状态与环境的pH密切相关,当环境达到特定的pH时,解离基团处于解离状态,酶与底物蛋白结合得较为完全,从而提高了单位时间内的生成率,也就增加了酶解速率[11]。过高或过低的pH都会使酶活力受到抑制,蛋白质的酶解效果也随之降低,从而影响了产品的纯度。因此,选取pH值为6.5较为合适。
2.1.2 酶添加量对硫酸软骨素提取质量的影响由图 5可以看出,随着酶添加量的增加,蛋白质含量呈先下降后上升的趋势,硫酸软骨素含量则迅速上升而后缓慢下降,当酶添加量为2%时,蛋白质含量达到最小值4.92%,硫酸软骨素含量达到最大值68.93%。说明在酶添加量较低时,部分底物无法与酶分子结合,蛋白质无法彻底水解,因而产物中含有较多杂质蛋白;当酶与底物作用达到饱和时,以蛋白多糖形式存在的CS得到充分释放,硫酸软骨素含量达到最高,继续增加酶添加量时,蛋白质水解程度不再提高,而酶本身是一种蛋白质,残留其中将导致产物纯度下降。综合试验结果,选择酶添加量为2%比较合适。
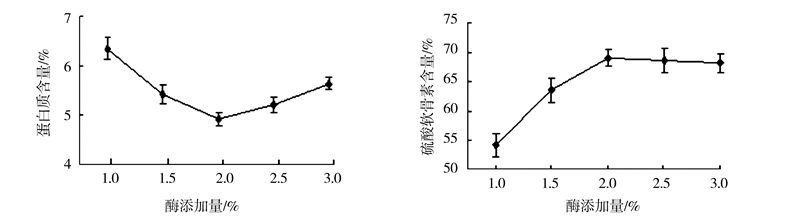
|
图 5 酶添加量对硫酸软骨素提取质量的影响 Fig.5 Effect of enzyme dosage on extraction of chondroitin sulfatefrom squid cartilage |
由图 6可知,随着酶解温度的升高,产物中蛋白质含量逐渐降低后又逐渐升高,在60℃时蛋白质含量达到最低,为5.06%,硫酸软骨素含量则随着温度的升高呈先上升后下降的趋势,当温度在60℃时硫酸软骨素含量达到最高,为69.73%。这表明在一定温度范围内,酶活力较高,水解蛋白质的程度也就越高。当温度过高时,易引起蛋白酶次级键的解离,致使蛋白酶降低或丧失其催化活性,从而降低了酶解效果;当温度过低时,酶解体系中的分子运动激烈程度减弱,减少了酶分子与底物分子碰撞的几率,导致酶解不充分。因此综合试验结果,酶解温度选择60℃为宜。
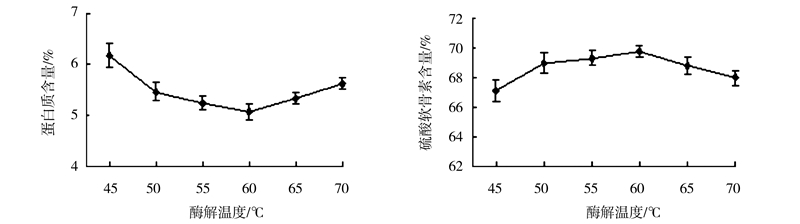
|
图 6 酶解温度对硫酸软骨素提取质量的影响 Fig.6 Effect of temperature on extraction of chondroitin sulfatefrom squid cartilage |
由图 7可以看出,随着酶解时间的延长,蛋白质含量开始下降,硫酸软骨素含量开始上升,在酶解反应达5 h左右,蛋白质含量与硫酸软骨素含量均达到最值,分别为4.9%和69.08%,继续延长酶解时间,蛋白质含量逐渐上升,硫酸软骨素含量逐渐下降。
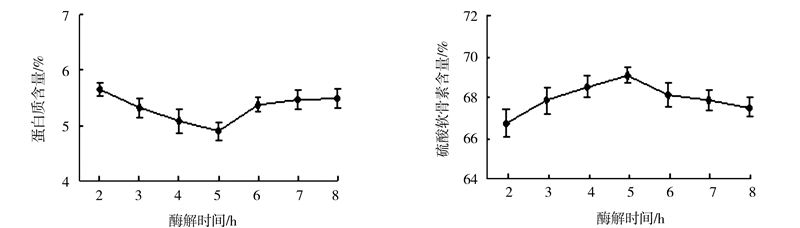
|
图 7 酶解时间对硫酸软骨素提取质量的影响 Fig.7 Effect of duration on extraction of chondroitin sulfatefrom squid cartilage |
这说明,增加一定的反应时间,能使酶与底物结合得较彻底,酶解得较充分,但酶解时间过长,可能致使酶活性降低或造成多糖的降解,从而导致硫酸软骨素含量降低。综合考虑,酶解时间选择5 h为宜。
| 表 2 正交试验结果 Table 2 Orthogonal experimental results |
酶解法制备硫酸软骨素工艺条件优化的正交试验结果如表 2所示,从表中可以看出,在9个试验设计组中,第5组的酶解效果最好,产物中硫酸软骨素含量最高且蛋白质含量最低,分别为69.43%和5.08%。通过直观分析可知,影响酶解产物中蛋白质含量和硫酸软骨素含量的各因素主次顺序均为A>B>C,即:pH>酶解温度>酶解时间。
由方差分析(表 3)可知,pH和酶解温度对酶解产物中蛋白质含量的影响均呈显著性(P<0.05),酶解时间因素的影响无显著性(P>0.05);pH对酶解产物中硫酸软骨素含量的影响达显著水平(P<0.05),酶解温度和酶解时间因素的影响不显著(P>0.05)。由酶解效应曲线图(图 8)可知,酶解法制备硫酸软骨素的最优工艺组合为A2B2C2,即pH6.5、酶解温度60℃、酶解时间5 h,所得的最佳工艺条件不在正交试验组中。
| 表 3 方差分析 Table 3 Analysis of variance |

|
图 8 酶解效应曲线 Fig.8 Effect of enzymatic hydrolysis |
为证明正交试验的可靠性,采用上述最佳工艺条件进行3次验证性重复试验,测得产物中蛋白质平均含量为4.97%,硫酸软骨素平均含量为70.11%,结果与第5组数值相接近,表明通过正交优化试验得到的最佳工艺条件合理、可靠。
3 结 论通过单因素及正交优化试验研究酶解法制备鱿鱼软骨硫酸软骨素的最佳工艺条件,试验结果表明,影响酶解效果的主要因素依次为,pH、酶解温度、酶解时间,最佳酶解工艺条件为pH6.5、酶解温度60℃、酶解时间5 h。经验证,在该条件下CS中蛋白质含量为4.97%,硫酸软骨素含量为70.11%,该结果说明通过正交优化的酶解工艺条件是可靠的。
| [1] | NICOLA VOLPI. Adsorption of glycosaminoglycans onto coral, a new possible implant biomaterials for regeneration therapy [J]. Biomaterials, 1999, 20:1395-1363.( 1) 1) |
| [2] | NICOLA VOLPI. Electrophresis separation of glycosaminoglycan on nitrocellulose membranes [J]. Analytical biochemistry, 1996,240:114-118.( 1) 1) |
| [3] | 陈守平.鲟鱼硫酸软骨素制备工艺的研究[D].福州:福建农林大学,2007.( 1) 1) |
| [4] | WAYNE KW,KATHLEEN G,ANDREW BG.Determination of chondroitin sulfate in nutritional supplements by liqulid chromatography [J]. Journal of Liqulid Chromatography & Related Technologies,2000,23 (18):2851-2860.( 1) 1) |
| [5] | 徐瑞聪,孙爱东,张德权,等. 二次回归正交旋转组合设计优化羊软骨硫酸软骨素提取工艺 [J]. 食品科技,2013,36(6):124-128.( 1) 1) |
| [6] | 孟年文.人工关节炎液治疗骨性关节炎[J].广西中医学院学报,2003,6(4):35-37.( 1) 1) |
| [7] | 王璋.食品酶学[M].北京:轻工业出版社,1990:95-102,181-185.( 1) 1) |
| [8] | 叶琳弘,刘秋凤,王茵,等. 碱液浸提法制备硫酸软骨素的工艺优化[J].福建水产,2014,36(6):428-435.( 1) 1) |
| [9] | 中国药典 2005 年:第2部[S].2005,附录 50-51.( 1) 1) |
| [10] | 高华,刘坤.间苯三酚分光光度法测定硫酸软骨素的研究[J].中国生化药物杂志,2007,21(5): 247-248.( 1) 1) |
| [11] | 毛善勇,周瑞宝,仪凯,等.Protamex水解牛肉的研究[J].郑州工程学院学报,2004,25(2): 61-63.( 1) 1) |
| [12] | 徐瑞聪. 羊软骨硫酸软骨素的提取分离及抗氧化活性研究[D]. 北京:北京林业大学,2014. |
 2015, Vol. 30
2015, Vol. 30
