2. 凯里学院应用化学研究所, 贵州 凯里 556011;
3. 凯里学院富硒中草药研究中心, 贵州 凯里 556011
2. Institute of Applied Chemistry, Kaili University, Kaili, Guizhou 556011, China;
3. Research center of selenium-riched Chinese Herbs, Kaili University, Kaili, Guizhou 556011, China
白补药Salvia scapiformis Hance var. Hirsute Stib为唇形科Lamiaceae多年生草本植物花径状丹参的全草,又名地埂鼠尾草、翻天雷公[1]。研究发现唇形科植物的化学成分主要有挥发油、二萜醌类、生物碱类、黄酮类、昆虫变态激素等[2, 3]。其中,黄酮类化合物具有延缓衰老、增强心血管功能、调节内分泌系统、抗肿瘤、抗过敏、抗病毒、抗辐射等作用[4, 5],在医药、食品、化妆品工业上,受到人们的广泛关注[6]。
目前对白补药仅见有关成分的研究[3],对白补药中总黄酮提取及含量的测定未见报道。贵州省的雷公山是我国中亚热带的一个极为珍贵的物种基因库,是贵州省中药材的主产区之一[7]。为寻找新的黄酮药源,以雷公山丰富的白补药为考察对象,分别通过微波、超声波、乙醇回流等提取方法提取白补药中总黄酮[8, 9, 10, 11],采用NaNO2-Al(NO3)3-NaOH显色,在506 nm处,以紫外分光光度法测定总黄酮含量[12],筛选出白补药总黄酮提取量高的方法,并对该提取方法进行优化,为进一步系统的开发利用雷公山白补药提供理论参考。
1 材料与方法 1.1 仪器与试剂仪器:紫外-可见光谱分析仪(UV-2550型,日本岛津公司);电子分析天平(FA1004、长沙市秋龙仪器设备有限公司);循环式真空泵[SHZ-D(III),巩义市科瑞仪器有限公司];万能高速粉碎机(北京永兴仪器有限公司);MAS-Ⅱ常压微波合成仪(上海新仪微波化学科技有限公司);WH-300超声清洗机(济宁万和电子设备有限公司)。
试剂:芦丁(国药集团化学试剂有限公司);无水乙醇、亚硝酸钠、氢氧化钠、硝酸铝均为分析纯。
材料:白补药2014年6月采于贵州雷公山,野生。样品经洗净、晒干、粉碎后过40目筛,备用。
1.2 试验方法 1.2.1 芦丁标准曲线的绘制最大吸收波长选择:吸取0.25 mL芦丁标准溶液和1.2.2黄酮提取液0.25 mL于4个 10 mL 容量瓶中,各加40%乙醇溶液至4mL,依次加入0.5 mL 5% NaNO2,摇匀,静置6 min,再加入0.5 mL 10% Al(NO3)3 ,摇匀,静置6 min,继续加入4 mL 4% NaOH,用40%乙醇定容至10 mL,摇匀,静置10~20 min,在200~700 nm进行光谱扫描。在506 nm处均有最大吸收,故以506 nm为黄酮测定波长。
标准曲线绘制:准确称取25.90 mg干燥至恒重的芦丁用少量40%乙醇溶解并转移至100 mL容量瓶中,用40%乙醇定容至刻度,摇匀,配得质量浓度为0.259 mg·mL-1的芦丁标准溶液。分别吸取0.0、0.6、1.0、1.4、1.8、2.2 mL芦丁标准液至6个10 mL容量瓶中,加入显色剂,在506 nm波长处测定吸光度。以芦丁质量浓度x(mg·mL-1)为横坐标,芦丁吸光度y为纵坐标,绘制芦丁标准曲线。
1.2.2 采用不同提取方法提取白补药总黄酮平行精确称取1 g白补药粉末3份,分别置于3个250 mL圆底烧瓶中,加入40%乙醇溶液30 mL浸泡30 min,3份样品分别采用回流(1 h)、微波及超声(温度50℃,功率300 W,时间3 min)等方法提取,然后分别过滤,用40% 的乙醇补足体积至30 mL,得白补药总黄酮回流、微波、超声提取液。每种提取方法均重复进行3次。提取液各取0.25 mL,在波长506 nm测定吸光度。根据以下公式计算总黄酮提取率:
| $ 总黄酮提取率\left( \% \right) = \frac{{C \times V \times n \times {{100}^{ - 3}}}}{m} \times 100\% $ |
式中:C表示样品液所测吸光度对应于标准曲线上的质量浓度(mg·mL-1);V表示样品提取液体积(mL);n表示提取液稀释倍数,m表示白补药样品质量(g)。
1.2.3 总黄酮提取单因素试验精确称取1 g白补药粉末于250 mL圆底烧瓶中,根据1.2.2试验结果,对提取率高的提取方法进行单因素实验,分别考察不同的乙醇浓度、料液比、时间、功率、提取次数对总黄酮提取率的影响。取提取液0.25 mL,在波长506 nm测定吸光度。重复3次。
1.2.4 精密度、稳定性、回收率实验精密度实验:精确称量1 g白补药粉末于圆底烧瓶中,按最佳条件提取总黄酮,取提取液0.25 mL,在波长506 nm测定吸光度,重复测定5次吸光度,计算白补药中总黄酮提取率和RSD。
稳定性实验:精确移取芦丁对照液0.25 mL,在波长506 nm测定吸光度,每隔10 min测定1次吸光度,共测10次,计算RSD。
回收率实验:精确称取同一批白补药1 g,按最佳条件提取总黄酮,分别精密加入芦丁对照品,取提取液0.25 mL,在波长506 nm测定吸光度,计算平均回收率和RSD。
1.2.5 最佳提取工艺验证实验精确称取白补药粉末1 g(平行5份)于5个250 mL 圆底烧瓶中,根据最佳工艺提取总黄酮,取提取液0.25 mL,在波长506 nm测定吸光度,计算总黄酮的提取率和含量。
1.3 数据处理采用SPSS19.0软件设计因素水平表,并对正交试验进行方差分析。
2 结果与分析 2.1 芦丁标准曲线方程将1.2.1试验结果进行线性回归,回归方程为y=11.125x+0.0047,R=0.9997。芦丁浓度在0.0155~0.0570 mg·mL-1范围内线性关系良好。
2.2 提取方法的确定采用回流、微波、超声等方法提取白补药中总黄酮,结果见图 1。微波提取法总黄酮得率最高为6.17%,其次为超声提取法5.37%,回流提取法最低4.62%。微波提取得率较高,且与回流提取和超声提取之间总黄酮提取率存在显著差异(P<0.05)。以上结果表明,微波提取白补药中总黄酮具有省时、高效、提取率高的优点,为此进一步优化微波提取条件。
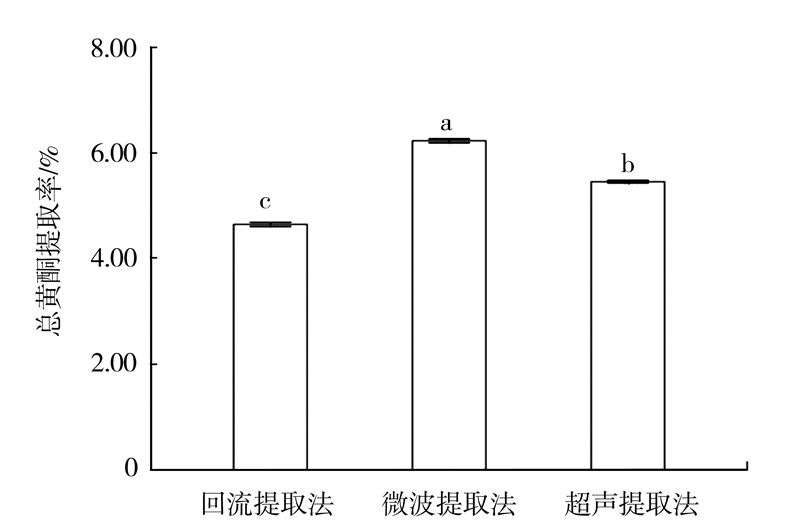
|
图 1 不同提取方法对总黄酮含量的影响 Fig.1 Effect of extraction methods on content of total flavonoids |
1∶10的料液比、50%乙醇、30℃温度浸泡白补药粉末2 min,分别以功率为变量(300、400、500、600、700、800 W),微波提取1 min,抽滤得提取液。取0.25 mL,测定吸光度。重复3次,结果如图 2所示。
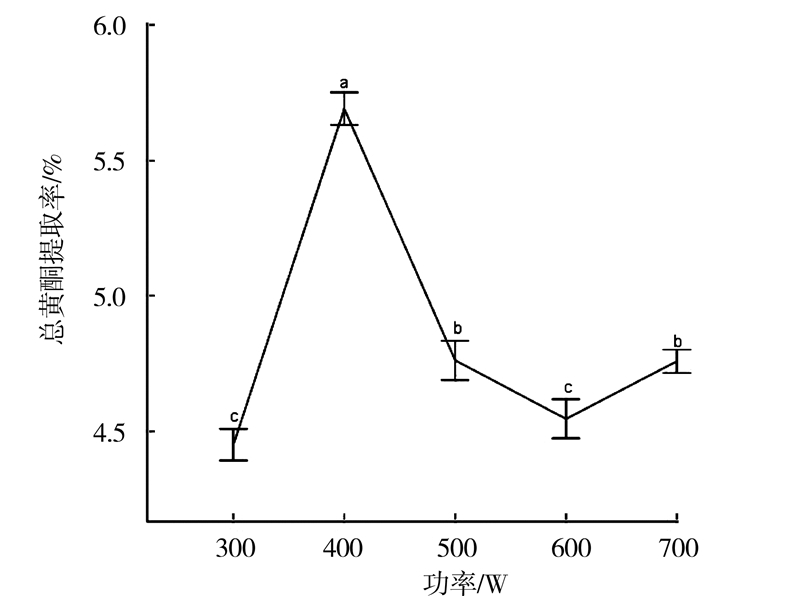
|
图 2 微波功率对总黄酮含量的影响 Fig.2 Effect of microwave power on content of total flavonoids |
由图 2可见,微波功率从300 W增至400 W时总黄酮提取率增至最大,之后随着功率增大提取率减小。微波功率增大会增加细胞的破碎程度,增加总黄酮溶出量,提取率增大;随着微波功率增大至一定临界点,可能会破坏黄酮类化合物,同时可能使更多脂溶性物质溶出,导致总黄酮得率减小[13]。差异分析表明,采用400 W的功率与300、500、600、700 W功率相比较,总黄酮提取率之间存在显著差异(P<0.05),故选择最佳提取功率400 W。
2.3.2 不同微波提取时间对白补药总黄酮含量的影响400 W功率,30℃温度、1∶10的料液比、50%乙醇浸泡白补药2 min,以微波时间为变量(1、1.5、2、2.5、3 min)提取、抽滤得提取液,取0.25 mL,测定吸光度。重复3次,试验结果如图 3所示。
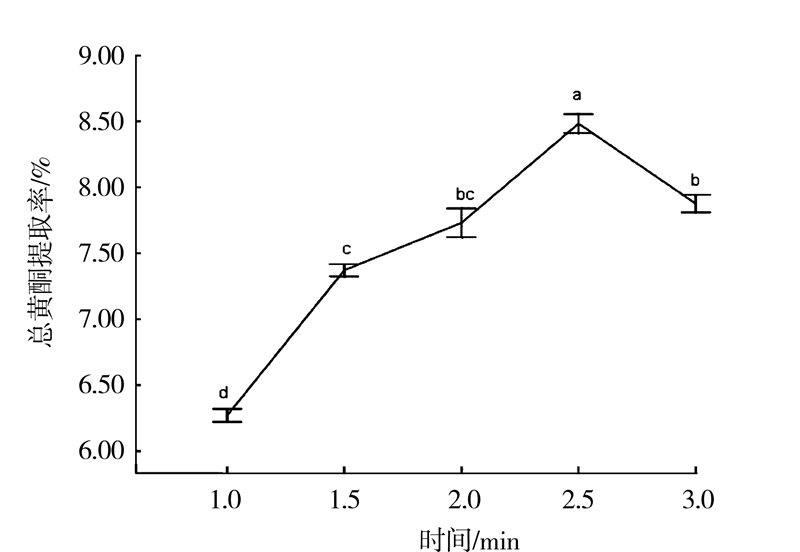
|
图 3 提取时间对总黄酮含量的影响 Fig.3 Effect of extraction time on content of total flavonoids |
由图 3可知,在1~2.5 min内,随着时间的增加,分子剧烈运动,致使植物细胞破碎,有效成分溶出,总黄酮提取率增加[14]。2.5 min时总黄酮提取率达到最大为8.45%,大于2.5 min提取率降低。同时差异分析表明,微波提取白补药中总黄酮2.5 min与1、1.5、2、3 min相比较,提取率之间存在显著差异(P<0.05),故提取时间2.5 min 为最佳。
2.3.3 不同料液比对白补药总黄酮提取的影响400 W功率、 30℃温度、50%乙醇,分别以料液比(g.mL-1)为变量(1∶10、1∶20、1∶30、1∶40、1∶50)浸泡白补药2 min,微波提取1 min,抽滤得提取液,取0.25 mL,测定吸光度。重复3次,结果如图 4所示。
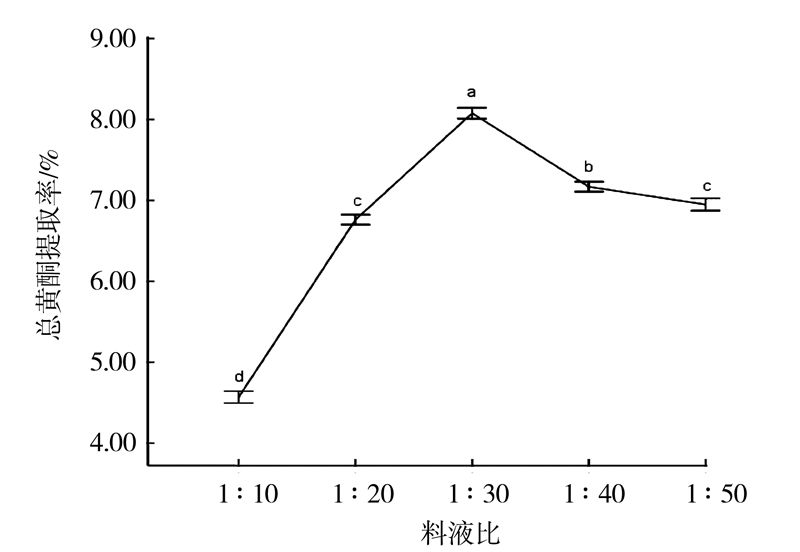
|
图 4 料液比对总黄酮含量的影响 Fig.4 Effect of material-liquid ratio on content of total flavonoids |
由图 4可知,料液比在1∶10~1∶30范围内,随着料液比的增大,溶剂的渗透作用增强,有利于黄酮的溶解及扩散,总黄酮的提取率增加,料液比为1∶30时,提取率达到最高值8.08%。料液比在1∶30~1∶50时,因为提取液体积增大后,升温速度变慢,导致1 min内微波提取率降低。另外差异分析表明,采用1∶30的与1∶10、1∶20、1∶40、1∶50的相比较,总黄酮提取率之间存在显著差异(P<0.05),故选择最适料液比为1∶30。
2.3.4 不同乙醇浓度对白补药总黄酮提取的影响400 W功率、30℃温度,1:30的料液比,以乙醇含量为变量(30%、40%、50%、60%、70%)分别浸泡白补药2 min,微波提取1 min,抽滤得提取液,取0.25 mL,测定吸光度。重复3次,试验结果如图 5所示。

|
图 5 乙醇浓度对总黄酮含量的影响 Fig.5 Effect of ethanol concentration on content of total flavonoids |
图 5结果表明,乙醇质量分数在30%~40%范围内,总黄酮提取率增大,40%时提取率达到最大值为8.06%。随着乙醇质量分数增加,提取率减小。这是因为总黄酮含黄酮苷及黄酮苷元,黄酮苷易溶于水,黄酮苷元难溶于水[15],故采用不同极性溶剂提取,总黄酮得率不同,40%乙醇对黄酮苷元和黄酮苷的溶解性较好,随着乙醇质量分数增加,溶剂极性减小,黄酮苷溶解性减小,总黄酮得率减小。同时通过差异分析表明,采用40%乙醇与30%、50%、60%、70%乙醇作溶剂相比较,总黄酮提取率之间存在显著差异(P<0.05),故选择乙醇质量分数为40%。
2.3.5 不同提取次数对白补药总黄酮提取的影响400 W功率、30℃温度、1∶30的料液比、40%乙醇浸泡白补药2 min,分别采取不同提取次数1、2、3、4次,微波提取1 min,抽滤得提取液,取0.25 mL,测定吸光度。重复3次,试验结果如图 6所示。
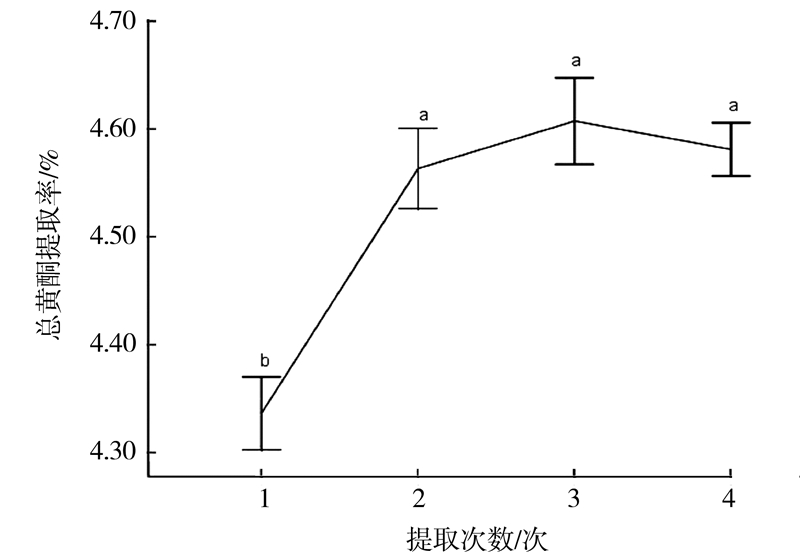
|
图 6 提取次数对总黄酮含量的影响 Fig.6 Effect of number of extraction on content of total flavonoids |
由图 6可见,提取次数对总黄酮含量的影响明显,提取次数由1次增加至2次时,总黄酮提取率增大,且差异分析表明提取1次和提取2次所得总黄酮的提取率之间存在显著性差异(P<0.05)。然而当提取次数由2次增大到4次时,总黄酮提取率不存在显著性差异(P>0.05)。分析认为,采用微波提取白补药中的总黄酮的最佳提取次数为2次。
2.4 正交试验根据单因素结果,设计4因素3水平对白补药总黄酮提取率影响的正交试验L9 (34)(表 1)。 采用SPSS 19.0软件系统,对正交试验结果进行方差分析,结果见表 2(R2=0.964)。选取检验的显著性水平为α=0.05,由表 2数据可看出,时间、料液比、功率、乙醇含量4个因素的检验P值均小于0.05,表明时间、料液比、功率、乙醇含量对白补药总黄酮提取率有显著影响,而且时间、料液比、功率、乙醇含量4个因素的自由度相等(df=2),故用F值来判断影响效果。由此影响白补药总黄酮提取率的主次因素为时间>乙醇浓度>功率>料液比。4个因素对白补药总黄酮提取率存在极显著的差异(P=0.000<0.05)。选用S-N-K法作均数间多重两两比较,结果见表 3,表明微波提取白补药中总黄酮的最佳条件为:时间2 min、料液比1∶40、功率400 W、乙醇质量分数50%。
| 表 1 正交试验的因素与水平 Table 1 Factors and levels of orthogonal test |
| 表 2 正交试验结果方差分析 Table 2 Variance analysis on orthogonal test results |
| 表 3 S-N-K分析结果 Table 3 Results of S-N-K analysis |
精密度试验结果相对标准偏差RSD为0.68%,表明该方法精密度良好。
NaNO2-Al(NO3)3-NaOH显色后的5~30 min内吸光度变化不大,RSD为0.16%,说明显色后30 min内稳定性好。加标回收率为98.01%,RSD为1.42%,表明该方法可靠性好。
2.6 最佳提取工艺验证根据最佳工艺提取白补药总黄酮,总黄酮的提取率和含量测定结果见表 4。表明用最佳工艺条件提取白补药中总黄酮的提取率为9.28%,高于其他各正交试验值,故最佳工艺条件可靠、稳定。首次测得雷公山白补药中总黄酮含量为92.58 mg·g-1。
| 表 4 最佳工艺的验证试验结果 Table 4 Verification test on optimized process |
以白补药为原料、乙醇为溶剂,对比回流、微波、超声3种提取方法对黄酮的提取。试验结果表示,微波提取法相比于超声和回流具有操作简便、成本低、无污染,提取率高、速度快等优点。本试验通过L9 (34)正交试验对微波提取法的乙醇浓度、提取时间、料液比、微波功率进行了优化。结果表示提取时间为2 min、料液比为1∶40、功率为400 W、乙醇质量分数为50%,间歇提取2次为最佳提取条件。在最佳的微波提取条件下,采用紫外分光光度法、NaNO2-Al(NO3)3-NaOH显色体系,测定了雷公山白补药总黄酮含量为92.58 mg·g-1,含量高于唇形科药用植物黄芩[13](18.34 mg·g-1)、夏枯草[14](50.50 mg·g-1)、紫苏[15](40.14 mg·g-1)、薄荷[16](21.60 mg·g-1)。并对该方法的精密度、稳定性、回收率进行了研究,结果表明,该方法具有良好的准确度、稳定性以及可靠性。本研究为开发贵州雷公山丰富的白补药资源提供了理论参考。
| [1] | 李时珍.本草纲目[M].吉林:延边人民出版社,2007:71.( 1) 1) |
| [2] | 梁莉,茹剑,薛倩等.唇形科(Labiatae)的研究进展[J].哈尔滨师范大学学报:自然科学版,2012,28(4):64-66.( 1) 1) |
| [3] | 肖艳华,崔猛,李艳艳,等.白补药石油醚部分的化学成分研究[J].化学与生物工程,2014,31(5):75-77.( 2) 2) |
| [4] | 黄河胜,马传庚,陈志武.黄酮类化合物药理作用研究进展[J].中国医药杂志,2000,25(10):499-503.( 1) 1) |
| [5] | 侯敏,马秀敏,丁剑冰.唇形科植物抗炎、抗过敏和抗氧化活性研究进展[J].科技导报,2009,27(4):98-101.( 1) 1) |
| [6] | GARG A,MITTAL S K. Review on Prosopis cinerana:A potential herb of Thar desert[J].Drug Invention Today,2013,5(1):60-65.( 1) 1) |
| [7] | 龙运光,袁涛忠,龙彦合,等.贵州雷公山地区苗族药用植物的调查研究[J].中国民族医药杂志,2009,(4):28-32.( 1) 1) |
| [8] | ZHANG Y,CAO J,WANG Y,et al.Simultaneous Determination of Glycyrrhizin and 15 Flavonoids in Licorice and Blood by High Perfomance Liquid Chromatography with Ultraviolet Detector[J].LSRN Analytical Chemistry,2013,(3013):1-8.( 1) 1) |
| [9] | 肖卫华,韩鲁佳. 黄芪黄酮乙醇回流提取工艺的研究[J].食品工业科技, 2008,28(1):233-235.( 1) 1) |
| [10] | 贤景春. 刺苋总黄酮的超声提取工艺研究[J].食品工业科技, 2012,33(1):250-255.( 1) 1) |
| [11] | 滕海鹏,仲山民,吴峰华,等.菊米黄酮的微波提取工艺研究[J].食品工业, 2011, (2):34-36.( 1) 1) |
| [12] | LIU Y, HAN J,WANG Y,et al.Selective separation of flavones and sugars from honeysuckle by alcohol/salt aqueous two-phase system and optimization of extraction process[J].Separation and Purification Technoligy,2013,118:776-783.( 1) 1) |
| [13] | 冯雷,吴冬青,王永生,等.黄芩总黄酮的提取及羟基自由基清除方法比较[J]. 中兽医医药杂志,2010, (5):7-10.( 2) 2) |
| [14] | 熊双丽,李安林.夏枯草总黄酮的提取分离与自由基清除活性研究[J].食品科学,2010,31(22):194-197.( 1) 1) |
| [15] | 胡浩斌,简毓峰,曹宏,等.正交试验法优选东紫苏中黄酮类化合物的提取工艺[J].中药材, 2006,29(3):296-298.( 2) 2) |
| [16] | 林彤,段金廒,钱大玮,等.薄荷黄酮类含量动态变化[J].中药材, 2006,29(9):888-890.( 1) 1) |
 2015, Vol. 30
2015, Vol. 30