2. 浙江省湖州市动物疫病与预防控制中心, 浙江 湖州 313000
2. Zhejiang Huzhou Center for Animal Disease Control and Prevention, Huzhou, Zhejiang 313000, China
坦布苏病毒(Tembusu virus)属于黄病毒科Flaviviridae黄病毒属Flavivirus成员。坦布苏病毒感染禽类最早于1999年在马来西亚鸡群中发现,但缺乏相关流行病学数据而未引起广泛的重视。2010年春季以来,我国南方多地种(蛋)鸭发生了以采食量迅速下降、产蛋率急剧下降、甚至停产及出现不同程度死亡为特征的鸭群新发传染病。该病可感染多品种鸭群,不同地区、不同品种鸭群发病率高低不一。鸭感染该病的典型剖检病变主要见于卵巢,表现为卵巢发育不良,卵泡变性、出血或破裂[1, 2, 3, 4, 5]。随后的研究发现,该病可感染蛋鸡、鹅和鸽子等禽类,建议将其命名为禽坦布苏病毒(Avian tembusu virus,ATMV)[6, 7, 8]。此外,还从相关鸭场养殖人员体内检测到坦布苏病毒抗体[9]。
坦布苏病毒基因组全长为10 990 bp,编码完整的多聚蛋白(polyprotein)前体,可切割为5′-C-prM-E-NS1-NS2A-NS2B-NS3-NS4A-NS4B-NS5-3′[10, 11, 12]。囊膜蛋白E常被用来检测黄病毒属病毒的血清学抗体,研究发现NS1蛋白也可作为血清检测有效手段[13]。本研究利用原核表达具有良好生物学活性的NS1重组蛋白,并以此为抗原建立禽坦布苏病毒的血清学诊断方法,为研究禽坦布苏病毒非结构蛋白NS1的结构与功能及建立禽坦布苏病毒诊断方法奠定基础。
1 材料与方法 1.1 病毒株和高免血清禽坦布苏病毒WR株及其高免血清由福建省农业科学院畜牧兽医研究所分离鉴定并保存。
1.2 试验试剂EasyPure Viral DNA/RNA Kit、肠杆菌感受态细胞DH5α和BL21均购自北京全式金生物技术有限公司。TaKaRa One Step RNA PCR Kit (AMV)、限制性内切酶EcoR I和XhoI、T4 DNA连接酶购自宝生物工程(大连)有限公司。HisPurTM Ni-NTA Purification Kit、常规和预染蛋白质标准购自Thermo Fisher Scientific。Gel Extraction Kit和Plasmid Mini Kit I购自广州飞扬生物工程有限公司。HRP标记的羊抗鸭IgG购自KPL公司。96孔酶标板购自Corning COSTAR。ELISA相关试剂和显色液等均购自武汉博士德生物工程有限公司。
1.3 非结构蛋白NS1的原核表达 1.3.1 引物设计利用OLIGO 7.37引物设计软件设计原核表达引物,引物序列为:上游引物NS1-F: 5′-CCGGAATTCGAGGCTTGGA-3′、下游引物NS1-R: 5′-CCGCTCGAGGACCTTTGA TTTGAT-3′,在上下游引物5′-端分别引入EcoR Ⅰ、Xho Ⅰ酶切位点,预期扩增片段为1 056 bp左右,引物均由生工生物工程(上海)股份有限公司合成。
1.3.2 原核表达载体构建 根据参考文献[1]提取坦布苏病毒的核酸,用设计的特异性上下游引物,使用TaKaRa One Step RNA PCR Kit (AMV)进行扩增,反应体系参考TaKaRa One Step RNA PCR Kit (AMV)说明书配制。RT-PCR扩增条件为:50℃ 30 min进行RT反应,94℃预变性5 min后进入循环,94℃变性1 min,53℃退火35 s,72℃延伸1 min,35个循环结束后,72℃终延伸10 min。反应结束后,将符合试验预期的目的条带经胶回收试剂盒切胶回收后克隆到T载体上,筛选出阳性重组质粒。将筛选出的阳性重组质粒和原核表达载体pET32a分别用EcoR I、XhoI进行双酶切,并对双酶切产物进行胶回收后用T4 DNA连接酶16℃进行连接过夜,转化DH5α感受态细胞后,筛选出的阳性重组质粒(pET32a-NS1)经序列测定为符合实验预期后备用。
1.3.3 非结构蛋白NS1原核表达及条件优化将阳性重组质粒pET32a-NS1转化BL21大肠杆菌感受态细胞中,筛选出符合试验预期的阳性重组质粒进行诱导表达。将构建好的原核表达阳性重组质粒菌液100 μL加入到10 mL LB培养基中震荡培养至OD值约为0.5时,加入IPTG至终浓度0.25、0.50、0.75、1.00 mmol·L-1,于不同时间段(诱导表达1、2、4、6 h)取表达产物100 μL,4 000 r·min-1 离心5 min后加入SDS-PAGE电泳上样缓冲液,置于-80℃冻存。
1.3.4 表达蛋白的生物学活性鉴定取优化后的最适条件诱导的菌液50 mL,5 000 r·min-1离心10 min,收集菌体,用10 mL PBS重悬后置于冰浴进行超声波破碎,超声程序为4 s间隔6 s,超声99次。待菌液变得清亮时,12 000 r·min-1离心5 min,分别收集上清和沉淀,按照常规方法进行SDS-PAGE电泳和western blot鉴定。
1.3.5 目的蛋白的纯化取优化后的最适条件诱导的菌液,经超生破碎后收集包涵体,对其按照 常规方法复性后,按照HisPur Ni-NTA Purification Kit试剂盒说明书进行蛋白的纯化。将纯化后蛋白进行SDS-PAGE电泳鉴定结果,利用Thermo Scientific NanoDrop 2000微量紫外分光光度计测定纯化后的蛋白浓度。
1.4 ELISA方法的初步建立 1.4.1 ELISA条件的优化将纯化的蛋白用碳酸盐包被液稀释后包被ELISA板,按常规ELISA条件优化的方法进行矩阵滴定优化各种反应条件,如抗原包被浓度、一抗稀释度、最佳二抗作用浓度、最佳显色时间和最佳反应时间的优化,初步确定ELISA最佳工作浓度。
1.4.2 阴阳性值的判定选取筛选出的DTMUV阴性血清30份,进行间接ELISA鉴定,每份血清重复2孔,计算其OD450 nm平均值及标准方差。阴阳性临界值=(阴性样本OD450 nm平均值+2×标准方差)。
1.4.3 特异性检测用优化后的间接ELISA方法分别对鸭主要常见病原高免血清进行ELISA检测与分析。本研究使用的主要血清有:产蛋下降综合征病毒(Egg drop syndrome virus,EDSV)、番鸭细小病毒(Muscovy duck parvovirus,MDPV)、1型鸭肝炎病毒(duck hepatitis virus type 1,DHV-1)、鸭源禽流感病毒(H5N1和H9N2)、禽1型副粘病毒(avian paramyxovims type l,APMV-1)、番鸭呼肠孤病毒(Muscovy duck reovirus,MDRV)和鸭疫里默氏菌(Riemerella anatipestifer,RA)1型和2型。阳性血清为WR株高免血清,阴性血清采自SPF鸭。
1.5 ELISA方法的初步应用 1.5.1 自然感染鸭与灭活苗免疫鸭血清的检测收集9份鸭坦布苏病毒灭活苗免疫的鸭血清和15份鸭坦布苏病毒自然感染鸭血清,经之前建立以纯化的病毒为包被原的间接ELISA检测为阳性的血清,用本研究建立的间接ELISA方法进行检测,并对两者的结果进行差异性分析,判定该重组蛋白能否用于自然感染与灭活苗免疫鸭血清的鉴别诊断。
1.5.2 临床样品的检测用本研究检测间接ELISA对临床采集疑似坦布苏病毒感染的68份鸭血清进行ELISA检测,评价本研究建立的NS1-ELISA在临床检测上的应用。
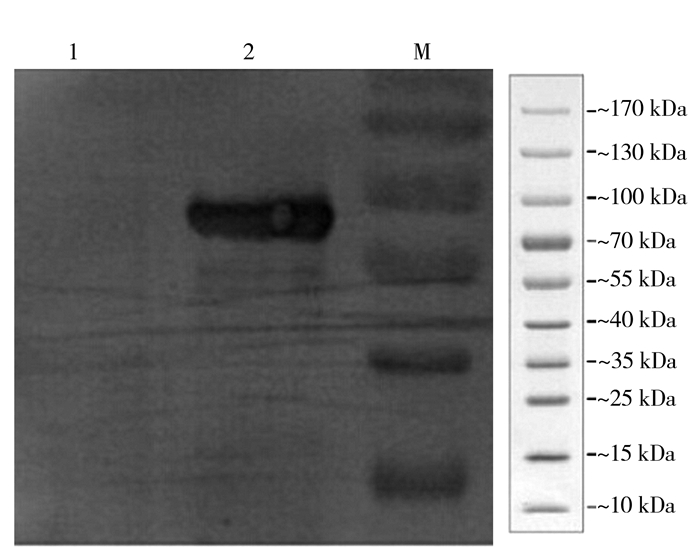
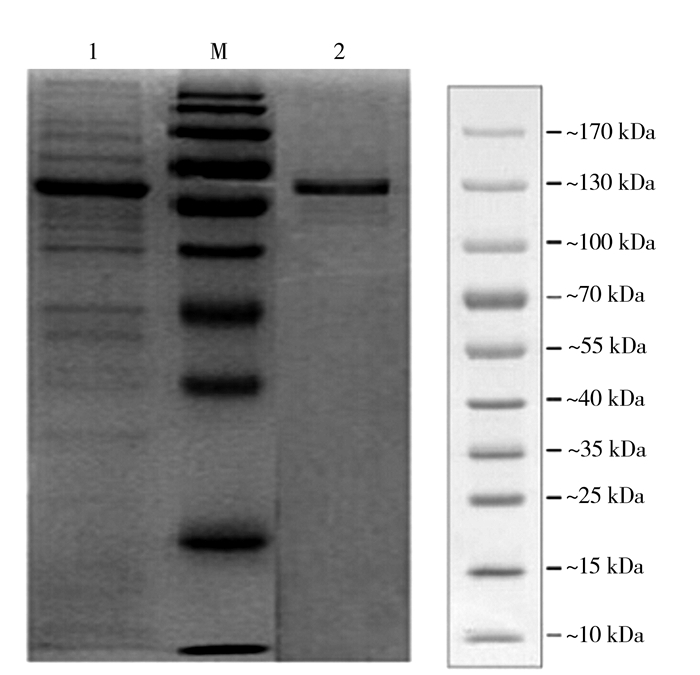
2 结果与分析 2.1 表达条件的优化对非结构蛋白NS1表达条件进行优化后,得到IPTG 0.5 mmol·L-1表达4 h可获得最优表达,表达的蛋白经SDS-PAGE分析主要为包涵体形式存在,蛋白大小约60 kd (图 1),经Western blot分析发现,表达的蛋白可与鸭高免血清发生特异性免疫反应,表明表达的NS1蛋白具有良好的生物学活性(图 2)。表达的蛋白经HisPurTM Ni-NTA Purification Kit纯化,经SDS-PAGE电泳检测可见均一的目的重组蛋白(图 3)。

|
图 1 非结构蛋白NS1原核表达的SDS-PAGE 分析 注:1为优化条件后的表达沉淀;2为优化条件后的上清液;M为蛋白分子量标准。 Fig.1 Identification of NS1 from pET32a-NS1 plasmid by SDS-PAGE |
|
图 2 非结构蛋白NS1原核表达的western blot分析 注:1为阴性血清;2为阳性血清;M为蛋白分子量标准。 Fig.2 Detection of NS1 by western blot analysis |
|
图 3 NS1蛋白的纯化 注:1为重组蛋白未纯化;2为重组蛋白纯化;M为蛋白分子量Marker。 Fig.3 Purified recombinant NS1 |
经优化后的ELISA条件为,抗原包被质量浓度为2.5 μ g·mL-1、一抗(鸭血清)最佳稀释度1:100、酶标二抗(HRP标记的羊抗鸭IgG)最佳稀释度1:3 000、作用时间为90 min、37℃避光显色5 min时P/N值最大。
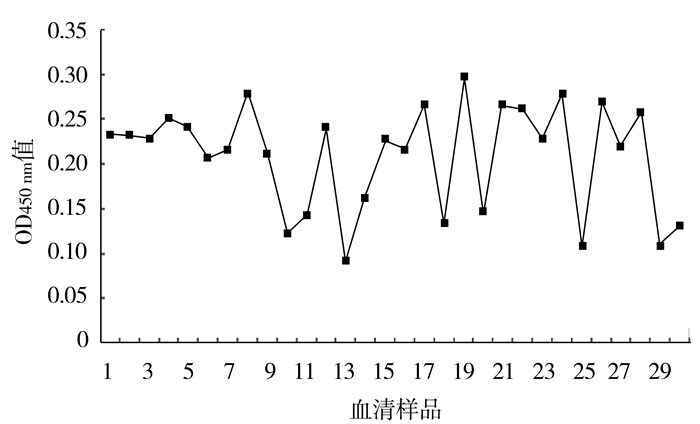
2.3 血清阴阳性判定根据间接ELISA检测结果计算出30份阴性血清的OD450nm平均值为0.206,标准差SD为0.056,当样品OD450nm≥(阴性血清OD450nm+2倍SD)时为阳性,反之为阴性,样品OD450nm≥0.318时判定为阳性,OD450nm<0.318时判为阴性(图 4)。
|
图 4 30份临床阴性样品的检测 Fig.4 Detection of 30 negative serum samples by indirect ELISA |
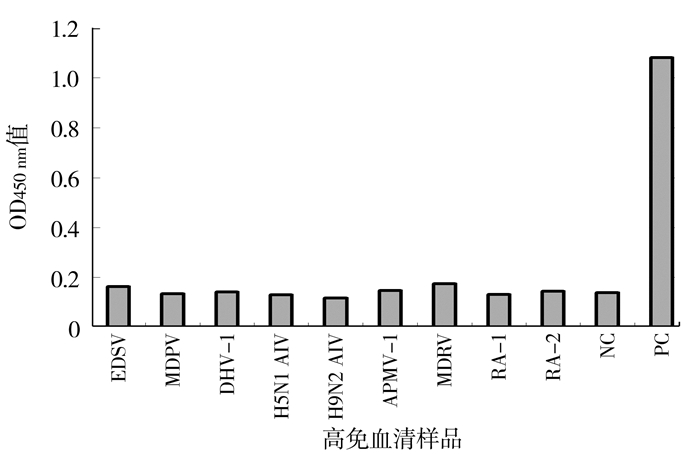
用建立的间接ELISA方法对产蛋下降综合征病毒(Egg drop syndrome virus,EDSV)、番鸭细小病毒(Muscovy duck parvovirus,MDPV)、1型鸭肝炎病毒(duck hepatitis virus type 1,DHV-1)、鸭源禽流感病毒(H5N1和H9N2)、禽1型副粘病毒(avian paramyxovims type l,APMV-1)、番鸭呼肠孤病毒(Muscovy duck reovirus,MDRV)和鸭疫里默氏菌(Riemerella anatipestifer,RA)1型和2型阳性血清(RA-1和RA-2)、鸭阴性血清(NC)和鸭源禽坦布苏病毒高免抗体(PC),测定其OD450nm值,均小于阴阳性临界值0.318,而阳性血清值为1.081(图 5),表明本试验建立的间接ELISA方法具有较好的特异性。
|
图 5 鸭常见病原高免血清ELISA检测 Fig.5 Indirect ELISAon serum samples collected from common duck infectious diseases |
24份经以全病毒包被抗原建立的ELISA检测为阳性的鸭血清,经本研究建立的ELISA检测均为阳性,表明建立的NS1-ELISA方法不能用于区分鸭群坦布苏病毒自然感染和鸭群坦布苏病毒灭活疫苗自然免疫血清感染。
2.5.2 临床样品检测用本试验建立的间接ELISA方法对临床采集的68份血清进行检测,结果显示阳性血清49份,阴性血清19份,阳性率为72.1%。
3 讨论与结论非结构蛋白NS1是黄病毒科黄病毒属病毒的一个较为保守的糖蛋白,推测其与病毒毒力相关。研究发现,黄病毒属病毒感染细胞后,其NS1蛋白或与细胞器相连,或分泌到细胞表面(选择性运输方式)或糖基化的方式释放到上清中等存在方式[14]。
研究发现,登革热病毒(黄病毒科黄病毒属)的非结构蛋白NS1存在膜结合型和分泌型2种主要形式,是登革热病毒具有较强免疫原性的蛋白。该非结构蛋白NS1可在登革热病人刚开始发热直至临床期结束时都可以被检测,甚至在登革病毒IgM抗体尚不能被检出的情况下,非结构蛋白NS1抗体就能在血清、尿液和脑脊液中被检出,已成为登革病毒早期感染的一种重要标志分子[15, 16, 17]。关于坦布苏病毒血清学快速诊断方法已有报道[18, 19],主要有全病毒抗原包被和表达E蛋白建立的ELISA方法和乳胶凝集方法进行血清学诊断的研究报道,但关于坦布苏病毒是否有类似登革热病毒NS1蛋白的相关生物学功能还有待进一步明确。
本研究根据禽坦布苏病毒非结构蛋白NS1特征,设计引物对其进行原核表达并进行生物学活性检测。结果表明,所获得重组蛋白为包涵体,并具有良好的生物学活性。建立的检测禽坦布苏病毒间接ELISA方法,具有良好的特异性、敏感性和重复性,可用于对禽坦布苏病毒血清学检测方法的有力补充。
综上所述,本研究建立的NS1-ELISA方法可以作为检测禽坦布苏血清学感染的储备方法,但该方法还不能用于对禽坦布苏病毒自然感染和灭活疫苗血清的鉴别诊断。
| [1] | 万春和,施少华,程龙飞,等.一种引起种(蛋)鸭产蛋骤降新病毒的分离与初步鉴定[J]. 福建农业学报,2010,25(6):663-666.( 2) 2) |
| [2] | 曹贞贞,张存,黄瑜,等.鸭出血性卵巢炎的初步研究[J].中国兽医杂志,2010,46(12):3-6.( 1) 1) |
| [3] | SU J, LI S, HU X, et al. Duck egg-drop syndrome caused by BYD virus, a new Tembusu-realated Flavivirus[J]. PLoS one, 2011, 6(3): e18106.( 1) 1) |
| [4] | CAO Z, ZHANG C, LIU Y, et al. Tembusu virus in ducks, China [J]. Emerg Infect Dis, 2011, 17(10):1873-1875.( 1) 1) |
| [5] | YAN P, ZHAO Y, ZHANG X, et al. An infectious disease of ducks caused by a newly emerged Tembusu virus strain in mainland China [J]. Virology, 2011, 417(1): 1-8.( 1) 1) |
| [6] | 傅光华,黄瑜,施少华,等.鸡黄病毒的分离与初步鉴定[J].福建畜牧兽医,2011,33(3):1-2.( 1) 1) |
| [7] | 刘友生,彭春香,傅光华,等.2010-2011年中国部分地区禽坦布苏病毒感染调查及分子变异分析[J].中国动物传染病学报,2012,20(1):47-53.( 1) 1) |
| [8] | LIU P, LU H, LI S, et al. Duck egg drop syndrome virus: an emerging Tembusu-related flavivirus in China [J]. Sci China Life Sci, 2013, 56(8): 701-710.( 1) 1) |
| [9] | TANG Y, GAO X, DIAO Y, et al. Tembusu virus in human, China [J]. Transbound Emerg Dis, 2013, 60(3):193-196.( 1) 1) |
| [10] | LIU M, LIU C, LI G, et al. Complete genomic sequence of duck flavivirus from china [J]. J Virol, 2012, 86(6):3398-3399.( 1) 1) |
| [11] | YUN T, ZHANG D, MA X, et al. Complete genome sequence of a novel flavivirus, duck tembusu virus, isolated from ducks and geese in china [J]. J Virol, 2012, 86(6):3406-3407.( 1) 1) |
| [12] | WAN C, HUANG Y, FU G, et al. Complete genome sequence of avian tembusu-related virus strain WR isolated from White Kaiya ducks in Fujian, China [J]. J Virol, 2012, 86(19):10912.( 1) 1) |
| [13] | CHAO D, LIU Y, SHEN W, et al. Comparison of E and NS1 antigens capture ELISA to detect dengue viral antigens from mosquitoes [J]. J Vector Borne Dis, 2015, 52(2):134-141.( 1) 1) |
| [14] | 陈月,任瑞文,刘建伟.登革病毒非结构蛋白1结构及功能研究进展[J].病毒学报,2014,(6):88-93.( 1) 1) |
| [15] | 傅强,田疆,方丹云,等.登革病毒NS1蛋白的原核表达及其在登革热快速诊断中的应用[J].中山大学学报:自然科学版,2012,33(3):316-321.( 1) 1) |
| [16] | RATHAKRISHNAN A, SEKARAN S. New development in the diagnosis of dengue infections [J].Expert Opin Med Diagn, 2013, 7(1): 99-112.( 1) 1) |
| [17] | GELANEW T, POOLE-SMITH B, HUNSPERGER E. Development and characterization of mouse monoclonal antibodies against monomeric dengue virus non-structural glycoprotein 1 (NS1) [J].J Virol Methods, 2015, 222: 214-223.( 1) 1) |
| [18] | 傅秋玲,陈珍,施少华,等.鸭坦布苏病毒E蛋白包被抗原间接ELISA方法的建立[J].福建农业学报,2015,30(1):1-5.( 1) 1) |
| [19] | 万春和,傅秋玲,陈珍,等.乳胶凝集试验方法在检测鸭坦布苏病毒抗体中的应用[J].福建农业学报,2013,28(12):1200-1203.( 1) 1) |
 2015, Vol. 30
2015, Vol. 30
