2. 新疆皇牛畜产品发展有限公司, 新疆 乌鲁木齐 832000
2. Xinjiang Huang Cattle Livestock Development CO. Ltd., Urumqi, Xinjiang 830000, China
湖羊原产于太湖流域,具有母性好、泌乳性能强和性成熟早的特点。因其多产多胎的性状,现已成为国内肉羊杂交改良的优良品种。近年来,对绵羊遗传育种的研究主要集中在对其经济性状功能基因的多态性研究,对于产奶性能的相关研究相对较少。但是由于该羊种多产多胎,营养相对不足、母羊泌乳力低下,从而导致羔羊发育不良、抵抗力低下、存活率下降等问题,使其多胎多产的优势未能发挥。因此本试验拟从分子遗传基础入手,研究高繁殖力湖羊泌乳基因,以期发现控制湖羊泌乳量大小的标记基因,为湖羊分子育种提供技术支撑。
研究表明不同种类的绵羊乳中的化学元素基本相同,但其产奶量受到遗传、胎次、环境[1]、年龄、营养水平、日照[2]、带幼畜数目、生理状态、挤奶方式等因素的影响[3]。家畜的泌乳性状是一个数量性状,是由多基因控制的,近年来对于泌乳基因的研究主要集中在牛[4]。催乳素基因(PRL)在促进哺乳动物个体的乳腺发育、乳汁生成、发动和维持泌乳方面发挥重要作用[5]。催乳素的表达曾被认为仅限于垂体,后经大量试验证明,PRL基因还可以在乳腺、淋巴细胞、大脑和蜕膜细胞、卵巢、前列腺、肾脏、脾脏等局部组织中表达[6, 7]。到目前为止,人们运用核酸原位杂交、测序分析和RT-PCR产物等技术已在多种动物的多个组织中检测到PRL基因的表达,且在不同动物、不同部位表达水平存在差异[8]。催乳素基因对动物的各种活动进行调控,尤其是与动物的生长和繁殖密切相关,对哺乳动物的泌乳、产仔、禽类的产蛋等生产性能具有重要作用。同时催乳素基因研究表明其对鸡的产蛋、牛的泌乳均有影响[9]。因此,PRL基因被视为对家畜泌乳性能具有重要作用的候选基因。本研究拟对湖羊PRL基因进行全基因测序分析,并探讨其与湖羊产奶性状的关系,以期为绵羊分子标记辅助选择提供参考。
1 材料和方法 1.1 试验样品及材料 1.1.1 试验动物2014年5~7月,在乌鲁木齐米东区塞外银铃种羊场随机挑选头胎、年龄1岁左右、体况良好,预产期、营养状况等基本一致的泌乳期湖羊41只。主要饲喂豆科(大豆等)和禾本科牧草(小麦、秸秆等),集中补充1次精料(约0.8 kg)。羊群均圈养,自由采食和饮水。首次完成人工挤奶后,静脉采取血样(5 mL·羊-1)用于提取DNA,肝素钠抗凝,-20℃保存。
1.1.2 试验试剂及仪器蛋白酶K、Taq酶均购自Takara公司,酚、氯仿、乙醇均购自济南化学试剂公司,FOSS5000系列乳成分测定仪购自丹麦。
1.2 乳的收集和乳成分测定采用人工挤奶的方法收集乳汁并计算泌乳量,具体方法为:产后第4 d(让羔羊尽量吃完初乳)20:00点,将羊羔和母羊隔离后,于次日凌晨7:00、13:30、20:00进行人工挤奶,计算日泌乳量;之后每周测产1次;同时,分别在56 d泌乳期的第1、4、8周(作为前、中、后期)测定日将采集的乳样早、中、晚根据泌乳量的不同,按比例取共计50 mL乳样混匀后-20℃冷冻保存。采用FOSS 5000 系列乳成分测试仪对样品进行检测,其中用Integrate milk TestingTMFossmatic 5000测定乳成分。测定指标包括乳蛋白率(%)、乳脂率(%)、乳糖率(%)、总固体(%)等。
1.3 基因组DNA的提取采用酚-氯仿法提取湖羊的基因组DNA[10],灭菌,TE溶解稀释后-20℃保存。用分光光度计检测DNA纯度,然后稀释成50 ng·μL-1备用。
1.4 PCR引物和试剂根据GenBank公布的羊催乳素基因序列(GenBank登录号NW_004080183.1),利用引物设计软件Primer5.0设计引物(表 1),由上海生工生物工程有限公司合成;蛋白酶K、Taq酶均购自Takara公司,酚、氯仿、乙醇均购自济南化学试剂公司。
| 表 1 PRL全基因引物 Table 1 Primer sequence of PRL gene |
PCR反应体系:10×buffer(含Mg2+)5 μL,10 pmol上下游引物各2.5 μL,TaqDNA聚合酶3 U,dNTPs(2.5 μmol·L-1)5 μL,DNA 2 μL,加超纯水至50 μL。
采用梯度PCR对所用引物进行扩增,确定每对引物的最适退火温度。PCR的反应条件:95℃预变性5 min;94℃变性30 s,52~62℃退火45 s,72℃延伸1~2 min,共35个循环;72℃延伸5 min。4℃保存。用2%琼脂糖凝胶电泳检测PCR扩增的产物。
1.6 SNP位点检测及其显著性检验采用BioEdit、Mega6.0和Chromas对测序所获得PRL基因的序列和峰图进行比对,检测SNP位点。用SPSS13.0软件统计数据,利用固定模型分析PRL基因型对产奶性状的遗传效应。对所测的湖羊不同基因型的性状差异进行显著性检验。
1.7 PRL基因的群体遗传分析基于PRL基因序列计算其基因频率、基因型频率,并进行Hardy-Weinberg平衡卡方适合性检验;计算位点纯合度(Ho)、位点杂合度(He)、有效等位基因(Ne)和多态信息含量(PIC),0.25 < PIC < 0.5属于中度多态[11]。以上数据均由GENEPOP分析获得。
1.8 位点连锁和单体型分析利用Haploview及在线软件Shesis,对PRL基因的SNP位点进行连锁不平衡和单体型分析。
1.9 SNP位点与生长发育性状的关联分析采用SPSS软件GLM过程,统计分析PRL基因单个SNP位点与泌乳性状的关联性、单体型组合与泌乳性状的关联性。模型结构如下:
Yijk=μ+Gi+eijk
Yijk表示泌乳性状的表型值,μ表示性状的平均值,Gi表示泌乳性状的基因型值,eijk指残差效应。
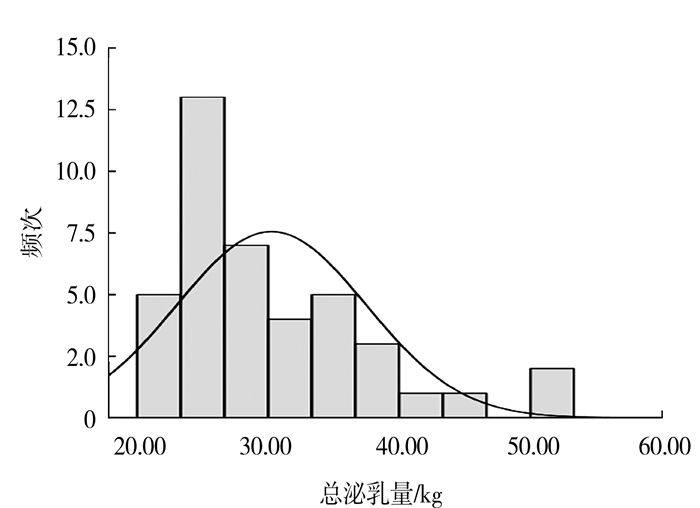
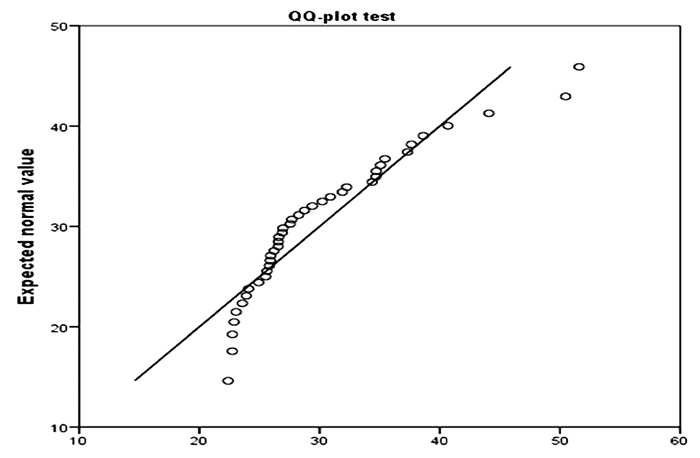
2 结果与分析 2.1 泌乳性状特征表 2列出了5个泌乳性状的5个描述性统计量。从表中可以看出湖羊群体个体泌乳量和乳成分差异较大。绘制出湖羊个体泌乳量包含正态曲线的脂肪,图中根据直方图(图 1)绘制出的曲线可以看出不符合正态分布,56 d内总泌乳量集中在20~30 kg。为进一步验证,利用Q-Q图进行检验发现:部分点偏离直线较远,说明数据不成正态分布(图 2)。从以上结果可以得出,湖羊个体总泌乳量呈偏态分布,更有利于后续的基因关联分析。
| 表 2 湖羊不同阶段泌乳性状统计描述 Table 2 Statistical description of sheep milk at different stages |
|
图 1 湖羊个体1~56 d总泌乳量分布 Fig.1 Total lactation of a single Hu sheep in 56 days |
|
图 2 湖羊个体总泌乳量正态分布检验 Fig.2 Normal distribution of total lactation by a single Hu sheep |
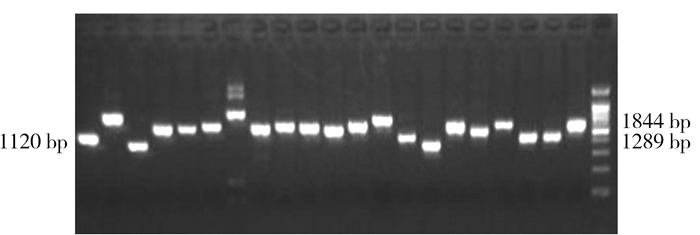
采用梯度PCR对引物的退火温度进行筛选,挑选部分PCR产物用1.5%琼脂糖凝胶电泳检测,结果如图 3,结果显示,条带清晰,无引物二聚体,特异性好。
|
图 3 PRL基因不同引物PCR产物结果 Fig.3 PCR products of PRL primers |
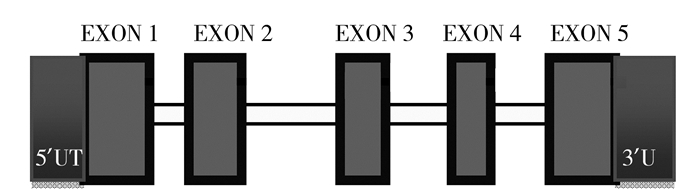
使用Bioedit整理上海生工生物工程有限公司返回的PRL基因序列数据,得到湖羊PRL基因全长为8 468 bp,含有5个外显子和4个内含子(图 4),整个蛋白由228个氨基酸组成。用MEGA6.0进行比对、拼接,使用Chromas查看峰图,找出23个SNP位点,部分结果如图 5。
|
图 4 湖羊催乳素全基因组成 Fig.4 PRL gene sequence of Hu sheep |
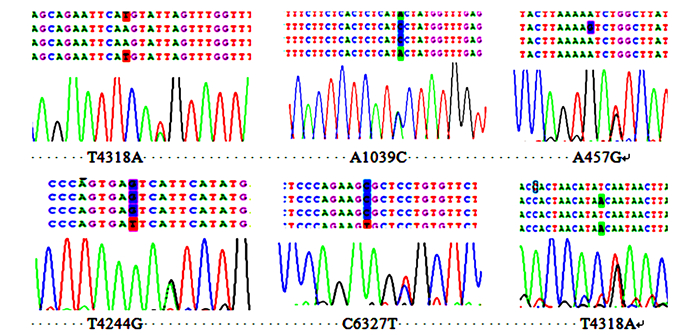
|
图 5 湖羊PRL基因部分SNP位点 Fig.5 Partial SNPs of PRL gene of Hu sheep |
遗传结构分析结果(表 3)表明:PR126、PR564、PR1039等16个位点处于中度多态(0.25 < PIC < 0.5),其多态信息含量较高,遗传变异较大,可以获得更多的选择结果,提示这些位点的整齐度随着样本量的增大还有进一步提高的潜能;PR413、PR457、PR801等7个位点处于低度多态(PIC < 0.25),多态信息含量较低,说明这些位点的遗传变异较小,选择潜力不大。皮尔逊χ2统计量显示,PR413、PR457、PR801等共15个位点处于Hardy-Weinberg平衡状态(P > 0.05),其余8个SNP位点均处于不平衡状态。说明8个SNP位点均受到选择压的影响,这可能与试验动物选育有关。
| 表 3 基因突变位点的遗传结构分析 Table 3 Genetic structure of PRL gene mutations |
用Haploview对PRL基因的23个SNP位点进行连锁不平衡分析,为方便软件分析,从PR126至PR8075分别命名为SNP1~SNP23,结果如图 6和表 4所示。根据连锁不平衡分析的定义,若2个多态位点的r2>0.33,就认为这2个位点处于强连锁状态,若r2 < 0.33,为弱连锁。从表 4可以看出,PR413和PR801、PR875表现为强连锁;PR457和PR875完全连锁,可以互相替代;PR1228和PR4591、PR5052、PR6277-PR6497表现为强连锁;PR1571和PR3286表现为强连锁;PR3228和PR3286、PR5052、PR5592、PR6497表现为强连锁;PR3286和PR4807、PR4995、PR5052两两之间表现强连锁;PR5592、PR6277、PR6327、PR6497两两之间表现为强连锁;其他突变间表现为弱连锁。
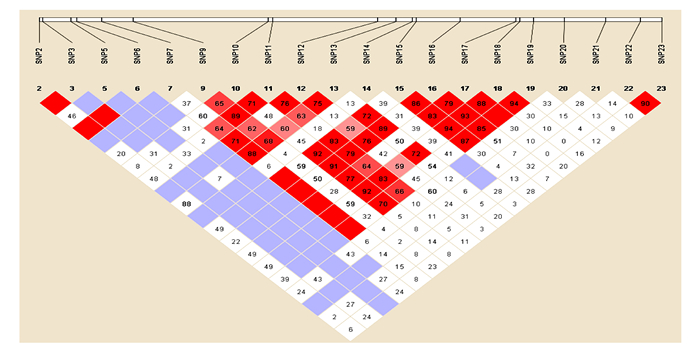
|
图 6 PRL基因连锁不平衡分析 Fig.6 Linkage disequilibrium analysis on PRL gene |
| 表 4 PRL基因SNP位点间的r2值 Table 4 r2 between SNPs of PRL gene |
根据基因遗传结果分析结果(表 3),结合连锁不平衡分析(表 4),突变位点的相关程度,以及SNP位点对应的基因型的样本数,只对样本含量符合统计要求的5个位点与泌乳性状进行相关性分析,5个位点为PR1039、PR1228、PR2351、PR4244和PR4591,分别位于序列第2内含子81 bp处,第2外显子71 bp处,第2内含子1 204 bp处,第3内含子952 bp处和第3内含子1 299 bp处。处于第2外显子的SNP位点PR1039 A > G氨基酸无变化,属于同义突变。
将PRL基因单个SNP位点基因型与湖羊泌乳期泌乳性状进行关联分析后发现:仅PR4244位点与泌乳量有关,其他4个位点均与泌乳性状相关,结果如表 5及表 6。
| 表 5 湖羊PR4244位点与泌乳量的显著分析 Table 5 Statistical analysis on PR4244 loci and lactation of Hu sheep |
| 表 6 湖羊单个SNP位点与泌乳性状的相关性分析 Table 6 Correlation between single SNP loci and lactation of Hu sheep |
由表 5和6可以看出,湖羊有共有4项泌乳性状与SNP位点相关,表现在SNP位点上有统计学意义。PRL4244位点GG型在第8周泌乳量显著高于TT型(P < 0.05);PR1039位点AC型中期乳脂率极显著高于AA型和CC型。PRL1228位点AC型前期乳脂率显著高于AA型和CC型(P < 0.05),AC型中期乳脂率极显著高于AA型和CC型(P < 0.01),中期总固体AC型显著高于CC型(P<0.05);PR2351位点,AG型前期和中期乳脂率显著高于AA型和GG型(P<0.05),AA型中期蛋白率极显著高于AG型和GG型(P<0.01),AG型中期总固体极显著高于AA型和GG型(P<0.01)。PR4591位点,CC型前期乳脂率极显著高于TT型,同时CC型中期蛋白率极显著高于TT型和TC型,前期固体率极显著高于TT型(P<0.01)。
2.7 湖羊PRL基因单体型及其频率分析利用在线软件Shesis对湖羊41个样品PRL基因测序结果进行分型,共分为25种单体型,其中有7种单体型频率大于0.02,每种单体型的乳成分和泌乳量如表 7所示。结果显示:单体型CCATT蛋白率显著高于AAATT型。其他各单体型的乳成分和泌乳量差异均不显著。
| 表 7 湖羊单体型频率与乳成分和泌乳量的相关分析 Table 7 Correlation between frequency of hapotype PRL gene and yield/composition of sheep milk |
泌乳性状是一种典型的由多种微效基因控制的数量性状,近年来国内在绵羊上的研究还没有。本试验对催乳素基因进行全序列测序、比对,在6个片段中找到23个SNP位点,与湖羊的泌乳性状的关联性进行研究,找到与泌乳量相关的SNP位点1个,与泌乳性状相关的SNP位点4个。由于国外如地中海地区饲养奶绵羊较多,故近年的研究中,关于影响绵羊泌乳性状的基因主要集中在国外,A. Crisa等12]在96只羊的16个候选基因上找到41个SNP位点,并进行单倍型分析,结果显示与乳脂率相关的SNP位点有:FASN g.56G > A,GHRHR g.73G > A and g.205T > C,and GDF8g.4312G > A and g.4319A > C。Hadjipavlou G等[13]在通过对尔俄斯羊PRL、GHR、DGAT1、ACAA2、acy1-CoA等基因分析,只有acy1-CoA影响泌乳量,其他候选基因与泌乳性状没有相关性或者缺失。以上研究中仅Hadjipavlou G等研究了PRL基因,但是没有找到与泌乳性状相关联的SNP位点。
3.2 催乳素基因多态性研究研究表明,绵羊催乳素整个蛋白由228个氨基酸组成,与牛、山羊氨基酸序列同源性达90%以上[14]。本试验通过测序分析,湖羊的氨基酸组成与前人研究结果一致,位于第2外显子的SNP位点PR1039A > G氨基酸无变化,属于同义突变。通过对PRL基因6个片段的测序分析结果可以看出,由于样本量较少,与泌乳性状相关的位于外显子上的SNP位点仅1个,故在后期的试验中应扩大样本量,重点研究位于编码区的SNP位点。本研究中使用的PCR产物直接测序法探讨泌乳性状与PRL基因的相关性,虽然国内外已有关于绵羊和牛PRL基因的研究,但他们均使用的是PCR-SSCP法。Vincent等[15]以绵羊催乳素基因2.5 kb的扩增产物为试验材料,利用HaeⅢ酶进行酶切得到了1 400、530、360、150 bp的A等位基因条带和1 400、510、360和150 bp的B等位基因条带。Brym等[16]扩增了娟姗和黑白花奶牛催乳素基因的一部分片段(整个外显子4和内含子3、4的一部分,共294 bp),利用SSCP和直接测序的方法,共发现了6个单核苷酸多态,其中的2个(8377S和8398R)与Schradin等[17]报道的突变重叠,另外2个(8307Y和8510Y)经检测是新的突变,而位于8314Y和8362Y处的2个突变是通过与GenBank中序列AF426315进行对比而探测到的。另外,运用MvaI内切酶限制性分析进一步证实了位置8 362 bp处核苷酸C的出现。Brym等[12]通过试验还发现,对于蛋白质的氨基酸序列而言所有检测到的突变都是沉默突变,没有引起催乳素基因功能的改变。自催乳素基因被发现以来,人们对它的定位、功能、调控的研究取得了较大进展。人们运用核酸原位杂交、测序分析RT-PCR产物等技术已在多种动物的多个组织中检测到PRL基因的表达,且在不同动物、不同部位表达水平存在差异。然而目前国内外对催乳素基因的组织结构、作用机理及其与泌乳量等繁殖性状的关系仍知之甚少,还需对这几方面做大量的探索工作,以期为提高湖羊繁殖力的高效育种提供一条新的途径。
3.3 催乳素基因多态性与泌乳性状的相关性分析本试验首次采取全基因测序的方法,克隆出PRL基因,全长为8 468 bp,含有5个外显子和4个内含子,找到PRL基因的23个突变位点,经过软件分析和统计,湖羊共有4项生长性状与PRL基因的5个SNP位点相关,表现在SNP位点上有统计学意义。研究首次在PRL基因上找到与泌乳性状相关的SNP位点,与其他学者不同的是,他们的研究主要集中在牛和其他绵羊品种上。Brym等[16]发现催乳素基因型与乳性能特征有显著的联系。AG基因型的黑白花奶牛具有明显的高产奶量,GG基因型奶牛在第1个泌乳阶段具有较高的乳脂率,AA基因型的泽西牛在第2个泌乳阶段具有较高的乳脂率。李吉涛等[18]采用PCR-RFLP技术,在99头荷斯坦牛中检测到催乳素基因AA、AB、BB 3种基因型,同时结合产奶性状进行最小二乘分析,结果表明,3种基因型的奶牛平均产奶量差异显著(P < 0.05),BB型高于AB型,AB型高于AA型;乳蛋白率差异极显著(P < 0.01),BB型最高,AA型最低;乳脂率差异不显著(P > 0.05),表明PRL基因对奶牛产奶性状具有重要影响。Khatami等[19]在Yaroslavl和黑白花奶牛中发现了由于催乳素的突变而出现不同基因型,PRL的RsaI多态性的BB基因型与牛的乳脂率呈负相关,结果与本试验相同。Elsa Garcia-Game[20]等通过全测序的方法在西班牙羊PRL序列上找到33个SNP位点,其中有4个在外显子上,在PRL基因上找到2个SNPs位点和牛奶产量性状之间检测到显著关联,但没有显示出对乳脂率的作用,其中SNP位点RRL4591 (T > C)与本试验相同,该位点与泌乳量显著相关。
本试验首次在国内报道了湖羊催乳素全基因多态性与泌乳性状的关联性分析,试验发现5个SNP位点与泌乳量和泌乳性状相关。在将来的研究中,需要对PRL基因的变异进行进一步分析,同时定义其在不同mRAN水平上的表达。所以,有必要通过增加样本量,分析SNP位点特别是外显子上的SNP位点与泌乳性状的关联性。
| [1] | RUSSO V M, CAMERON A W N, DUNSHEA F R,et al. Artificially extending photoperiod improves milk yield in dairy goats and is most effective in late lactation[J].Small Ruminant Research,2013,113:179-186.( 1) 1) |
| [2] | EDYTA M,TOMASZ M, KATARZYNA R, et al.Short-day and melatonin effects on milking parameters, prolactin profiles and growth-hormone secretion in lactating sheep[J]. Small Ruminant Research, 2013,109:182-187.( 1) 1) |
| [3] | ASIF MAHMOOD,SUMARIA USMAN. A comparative study on the physicochemical parameters of milk samples collected from buffalo,cow, goat and sheep of Gujrat [J].Pakistan Journal of Nutrition,2010,9(12): 1196-1197.( 1) 1) |
| [4] | 张耀,郭定宗. 催乳素结构与功能研究进展[J]. 动物医学进展, 2007, 28(5): 49-52.( 1) 1) |
| [5] | KELLY P A, BACHELOT A, KEDZIA C, et al. The role of prolactin and growth hormone in mammary gland development[J].Mol Cell Endocrinol, 2002,197 (2):127-131.( 1) 1) |
| [6] | HARIGAYA T, KOMORI M, WATANABE H, et al. Prolactin gene expression in mouse pancreatic islets.[J]Endocrinol,2002,73(1):29-34.( 1) 1) |
| [7] | HORIGUCHI K, YAGI S, ONO K, et al. Prolactin gene expressioin in mouse spleen helper T cells.[J]Endocrinol, 2004,183(3):639-646.( 1) 1) |
| [8] | ARANDA J, RIVERA J C, JEZIORSKI M C, et al. Prolactin are natural inhibitors of angiogenesis in the retina[J]. Invest Ophthalmol VisSci,2005,46(8):2947-2953.( 1) 1) |
| [9] | 赵秀华,褚明星,刘荣志, 等. 催乳素基因的研究进展[J]. 遗传繁育, 2007, 34(11): 28-34.( 1) 1) |
| [10] | J·萨姆布鲁克, D W拉塞尔. 分子克隆实验指南:第 3版[M]. 北京: 科学出版社, 2002, 8.( 1) 1) |
| [11] | 何凡.人工培育藏猪种群SLA-DRB和POU1F1基因SNP与与生长发育性状的关联分析[D]. 四川: 四川农业大学, 2013.( 1) 1) |
| [12] | CRISA A, MARCHITELLI C, PARISET L G,et al. Exploring polymorphisms and effects of candidate genes on milk fat quality in dairy sheep[J]. J Dairy Sci, 2010, 93:3834-3845.( 1) 1) |
| [13] | HADJIPAVLOU G,ORFORD M,TZAMALOUKAS O, et al. Genetic analysis of Chios sheep:Candidate genetic loci and their association with milkTrait[C]//4th International Conference of Quantitative Genetics, 2012:257-259.( 1) 1) |
| [14] | UDINA I G,TURKOVA S O,KOSTIUCHENKO M V, et al. G E.Polymorphisn of cattle prolactin gene; microsatellites, PSR- RFLP [J]. Genetika Apr, 2001, 37 (4): 511-516.( 1) 1) |
| [15] | VERA-LASTRAO, JARA L J, ESPINOZA L R, et al. Prolactin and autoimmunity .Autoimmun[J]. Rev, 2002, 1(6): 360-364.( 1) 1) |
| [16] | BRYM P, KAMINSKI S, WOJCIK E, et al. Nucleotide sequence polymorphism within exon 4 of the bovine prolactin gene and its associations with milk performance traits[J]. J Appl Genet,2005,45(2): 179-185.( 2) 2) |
| [17] | SCHRADIN C,ANZENBERGER G.Development of prolactin levels inmarmoset males:From adult son to first-time father[J]. Horm B-havior,2004,46(5):670-677.( 1) 1) |
| [18] | 李吉涛,杜立新.中国荷斯坦牛催乳素基因型与产奶性状的相关分析[J].山东农业大学学报,2004,35(4):553-555.( 1) 1) |
| [19] | KHATAMI S R,LAZEBNYI O E,MAKSIMENKO V F,et al.Association of DNA polymorphisms of the growth hormone and prolactin genes with milk productivity in Yaroslavl and black-and-white cattle[J]. Genetika, 2005,42(2):229-236.( 1) 1) |
| [20] | ELSA GARCIA-GAMEZ, MARTA GARCIA-FERNANDEZ, JOSE ALEJANDRO MORAN,et al. Association analysis between Prolactin SNPs and milk production traits in Spanish Churra sheep: preliminary results[C]// ISAG,2010.( 1) 1) |
 2015, Vol. 30
2015, Vol. 30
