2. 福州市蔬菜科学研究所, 福建 福州 350111
2. Institute of Vegetable Science of Fuzhou, Fuzhou, Fujian 350111, China
苋菜种类繁多,营养丰富,适应性强,种植广泛[1, 2, 3, 4]。近些年,食品安全问题日益严峻,人们对天然色素的关注越来越多。苋菜富含甜菜红色素,其取材方及色素的提取较为方便,使得它渐渐替代甜菜作为一种重要的天然色素提取资源的地位。
在苋菜中,甜菜红色素主要以苋菜苷和异形苋菜苷形式存在[5]。甜菜红色素合成途径目前逐渐清晰,其中涉及的主要酶和基因主要有酪氨酸酶、双加氧酶、多巴脱羧酶和糖基转移酶。糖基转移酶分为两类,一类是甜菜苷5-氧-糖基转移酶和甜菜苷6-氧-糖基转移酶,分别利用UDP-葡萄糖形成糖苷甜菜苷5-氧-糖甙和甜菜苷6-氧-糖甙;另一类只有一个是4,5环多巴5-氧-糖基转移酶,环多巴葡萄糖苷通过其他路径进行的糖基化[6, 7, 8]。Wyler等[9]发现在甜菜的幼根和老根中环多巴糖甙的含量占总甜菜红素含量的46%和12%,认为环多巴糖甙参与或涉及甜菜碱的合成途径。Sasaki等[10, 11, 12]在鸡冠花花朵的粗提物中观察到cyclo-DOPA5-O-glucosyltransferase的活性,并认为催化cyclo-DOPA glucoside直接完成糖基化,而不是在甜菜苷进行,它导致一条新的基于酪氨的甜菜红素生物合成途径。DOPA5-GT编码的基因在籽粒苋(Amaranthus hypochondriacus)[13]、鸡冠花(Celosia cristata)和紫茉莉(Mirabilis jalapa)[14]等多种石竹目植物中得到克隆。甜菜红素的合成受多种因素的影响,其中光对色素的累积影响较大。Zhao等[15]通过试验表明光质和光强影响盐地碱蓬甜菜红色素的合成。光质也影响甜菜毛状根甜菜红色素的累积[16]。在不同光质中,蓝光比红光更有利于甜菜红色素的积累[17]。
在本课题组之前的研究中,以苋菜转录组测序结果作为参考[18],利用RT-PCR结合RACE技术成功克隆到苋菜AmaDOPA5-GT基因(GenBank登录号:KP174811)。DOPA5-GT是甜菜红色合成途径中关键基因[6, 7, 8, 9],为进一步挖掘该基因在苋菜苷合成过程中的作用,本研究中对AmaDOPA5-GT基因进行了生物信息学分析,并通过构建AmaDOPA5-GT-GFP表达载体研究该基因编码的蛋白的亚细胞定位情况。另外,本试验利用交错式热不对称PCR染色体步移(Tail-PCR)技术对AmaDOPA5-GT启动子进行克隆并对其进行在线功能预测,根据预测的结果,对苋菜进行不同光质处理,研究不同光质对AmaDOPA5-GT的表达量及苋菜苷含量的影响。
1 材料和方法 1.1 材料供试红色苋菜品种为“大红苋菜”,购于福州种子市场。
1.2 方法 1.2.1 生物信息学分析根据前期获得的AmaDOPA5-GT基因序列(KP174811)利用在线软件对其进行生物信息学分析[19]:利用ExPASy Prot-param软件(http://web.expasy.org/protparam/)进行蛋白理化性质分析;利用Plant-mPLoc软件(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)预测蛋白的亚细胞定位情况;利用ProtScale软件(http://web.expasy.org/protscale/)分析蛋白亲水性;利用NetPhos 2.0 Serve软件(http://www.cbs.dtu.dk/services/NetPhos/)预测蛋白磷酸化位点;利用SignaIP 4.1 Server软件(http://www.cbs.dtu.dk/services/SignalP/)预测蛋白信号肽;利用TMpred Server软件(http://www.ch.embnet.org/software/TMPRED_form.html)预测蛋白跨膜结构;利用PSIPRED软件(http://bioinf.cs.ucl.ac.uk/psipred/)预测蛋白的二级结构;利用DNAMAN6.0对AmaDOPA5-GT和其他植物糖基转移酶家族的氨基酸序列进行多重比对;利用Mega 5构建进化树。
1.2.2 AmaDOPA5-GT亚细胞定位分析利用DNAMAN 6.0软件分析该基因ORF区序列和载体PCAMBIA1302-GFP中的酶切位点并设计引物(表 1),以苋菜cDNA为模板克隆目的片段,送测验证正确后进行载体构建和转化农杆菌。蛋白亚细胞定位参照林丽霞等[20]的方法:将1 cm2左右大小的洋葱在MS培养基上预培养1 d后,在准备好的农杆菌悬浮液中浸泡20 min。然后取出洋葱表皮,内表皮朝下平铺于MS培养基上,25℃共培养2 d。用无菌MS液体培养基清洗2~3次后在荧光共聚焦显微镜(A1 Nikon)观察绿色荧光蛋白信号。为区分定位结果是在细胞膜还是在细胞壁,还需将洋葱表皮置于30%的蔗糖溶液中质壁分离后再观察。
1.2.3 AmaDOPA5-GT基因启动子克隆与分析以苋菜子叶为材料进行DNA的提取。根据TaKaRa Genome Walking Kit引物设计原则设计Tail-PCR引物(表 1),采用交错式热不对称PCR染色体步移(Tail-PCR)进行启动子扩增。以Genome Walking Kit(TaKaRa)自带上游引物(AP1、AP2、AP3和AP4)与设计的AmaDOPA5-GT基因特异引物为下游引物进行三轮热不对称PCR扩增,获得该基因上游启动子序列。利用在线软件Promoter 2.0(http://www.cbs.dtu.dk/services/Promoter/)预测AmaDOPA5-GT启动子可能的转录起始位点;利用在线软件PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)软件预测启动子顺式作用元件。
| 表 1 PCR引物序列 Table 1 Primers used in PCR |
取“大红苋菜”种子0.25 g,用75%的酒精消毒30 s,均匀地撒播在直径12.4 cm平铺有四层无菌滤纸(含15 mL无菌水)的培养皿中。在不同颜色冷光源下进行培养,培养温度为25℃,光照时间16 h·d-1。不同光质处理为:白、暖白、蓝、绿、红(电压:220 V,功率:18 W)和暗6个处理。培养7 d后,取幼苗用于甜菜红素测定和RNA提取,每个试验重复3次。
1.2.5 实时定量PCR(qRT-PCR)分析qRT-PCR采用TaKaRa公司生产M-MLV反转录试剂盒,参照说明的20 μL标准反转录体系进行反转录合成cDNA 第一链。以反转录产物为模板,以EF1a基因作为内参基因,进行实时定量RT-PCR 验证。所使用荧光定量PCR仪为罗氏LightCycler480。目的基因相对表达量的计算公式如下:基因的相对表达量=(内参基因E△Cp)/(目的基因E△Cp),其中E为扩增效率,△Cp为各个时期Cp值与参照时期Cp值的差值。
称取0.5 g苋菜新鲜组织,液氮中进行研磨,研磨完迅速加入7 mL预冷甲醇,剧烈振荡混匀,于4℃放置30 min,12 000 r·min-1离心10 min,去上清,用双蒸水重悬沉淀,4℃ 30 min,12 000 r·min-1离心取上清水相,用紫外分光光度计在536 nm下测吸光值。根据甜菜红素的摩尔消光系数5.66×104计算甜菜红素的绝对含量[13,15]。
2 结果与分析 2.1 AmaDOPA5-GT基因生物信息学分析根据获得的AmaDOPA5-GT (Kp174811)基因的cDNA序列进行生物信息学分析,该基因cDNA全长1 680 bp,开放阅读框(ORF)长1 434 bp,编码477个氨基酸,5′-UTR 54 bp,3′-UTR 192 bp,Ploy A尾巴长31 bp。由于PCR扩增的AmaDOPA5-GT基因的gDNA序列与cDNA序列完全相同,推测该基因没有内含子。理化性质分析结果表明:该基因所编码的蛋白分子量为54 084.0,分子式为C2433H3770N656O696S23,等电点(PI)为6.05,不稳定系数为51.96,带负电氨基酸数为50个,带正电氨基酸数为57个,亲水系数为-0.231;Plant-mPLoc在线软件预测表明:AmaDOPA5-GT定位在细胞膜上。ProtScale分析结果显示这个基因为亲水性蛋白;NetPhos 2.0 Serve软件预测显示AmaDOPA5-GT蛋白磷酸化位点有12个(Ser:8 Thr:1 Tyr:3);采用SignaIP 4.1 Server蛋白质信号肽预测结果显示这个基因不具有信号肽;用TMpred Server软件进行跨膜结构预测显示是AmaDOPA5-GT跨膜蛋白。用PSIPRED软件预测蛋白质的二级结构,AmaDOPA5-GT由40.38%的α螺旋、14.44%的延伸链和45.19%自由折叠组成。使用DNAMAN6.0软件对AmaDOPA5-GT和其他植物糖基转移酶家族的氨基酸序列进行多重比对,发现在碳端有1个44个氨基酸残基组成的保守UDP结合位点(PSPG-box,图 1),还有1个所有糖基转移酶的保守序列[19,20],证明该基因属于糖基转移酶家族成员。

|
图 1 AmaDOPA5-GT氨基酸序列与其他物种DOPA5-GT蛋白氨基酸序列多重比对结果 注:下划线表示糖基转移酶的特征序列(PSPG box),方框区域为UGT的保守区。 Fig. 1 Multiple alignment of deduced amino acid of AmaDOPA5-GT and DOPA5-GTs from other species |
进化树分析结果表明AmaDOPA5-GT与其他几个植物的5-GT聚在一个分枝上(图 2),其中与同属的籽粒苋的DOPA5-GT覆盖率和相似度最高,分别高达100%和95%,与鸡冠花、三角梅和紫茉莉的亲缘关系依次降低,与亲缘关系最远的紫茉莉的DOPA5-GT的覆盖率和相似度也分别高达98%和57%,AmaDOPA5-GT次分支和Betanidin 5-GT的次分支相邻,都聚到石竹目的1个主要分支上,和Casique-Arroyo等[13]的研究结果一致。

|
图 2 AmaDOPA5-GT与其他植物GT氨基酸序列的进化树 注:图中分支点的数字表示Bootstrap验证中基于1 000次重复该节点可信度的百分比(%)。 Fig. 2 Phylogenetic tree of amino acid sequences of AmaDOPA5-GT and GTs from other plants |
亚细胞定位结果表明AmaDOPA5-GT定位于细胞膜上,与在线软件预测一致。空载体融合蛋白在洋葱表皮细胞细胞膜、细胞质和细胞核等部位都有表达(图 3)。
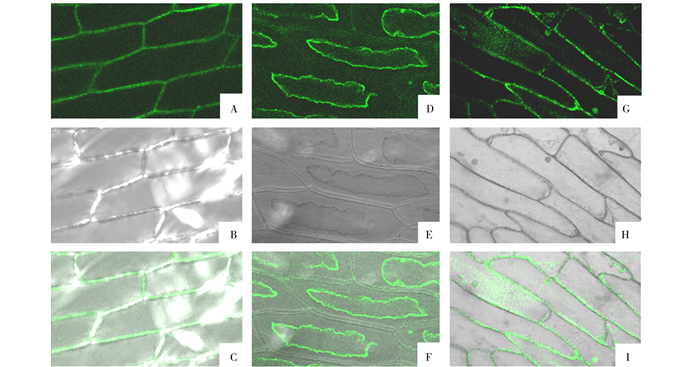
|
图 3 35S::AmaDOPA5-GT-GFP蛋白亚细胞定位结果 注:A~C为细胞质壁分离前;D~F为细胞质壁分离后;G~I为空载体定位结果,A、D和G为荧光图,B、E和H为白场图,C、F和I为叠加图。 Fig. 3 Subcellular localization of 35S::AmaDOPA5-GT-GFP protein |
通过测序获得1 393 bp的序列,其中与AmaDOPA5-GT基因的gDNA序列重叠71 bp,证实该片段为AmaDOPA5-GT基因5′端调控序列(图 4)。Promoter 2.0分析结果表明AmaDOPA5-GT启动子可能的转录起始位点在起始密码子上游500 bp位置,可信度值为1.050; PlantCARE分析共预测到29个顺式作用元件,有多个与植物响应的作用元件(图 4),其中植物光响应元件有8个;茉莉酸甲酯相应元件2个;水杨酸相应元件1个;乙烯响应元件1个;赤霉素响应元件1个。AmaDOPA5-GT基因启动子中植物光响应元件数目较多,说明光对该基因的表达影响较大。

|
图 4 AmaDOPA5-GT 基因启动子分析结果 注:红框内碱基代表AmaDOPA5-GT 基因起始密码子,红箭头部分为与AmaDOPA5-GT基因重叠序列 Fig. 4 Analysis on AmaDOPA5-GT promoter |
在不同的光处理下,蓝光处理中苋菜幼苗甜菜苷含量最高,是暗处下幼苗中苋菜苷含量的8倍左右,其次是白光和复合光也出现类似情况,绿光和红光更少,但也比暗处理条件下的多,最少的是暗处理(图 5A)。
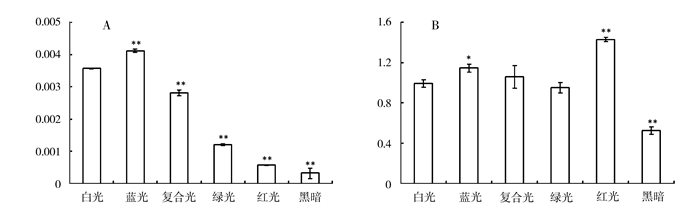
|
图 5 不同光照处理对苋菜幼苗苋菜苷含量(A)和AmaDOPA5-GT(B)表达的影响 注:*表示差异显著(P-value≤0.05);**表示差异极显著(P-value≤0.01)。 Fig. 5 Effect of light of different wavelengths on amaranthin and AmaDOPA5-GTexpression in Amaranth tricolor |
在不同光质处理下,红光照射下,AmaDOPA5-GT基因表达量最高,是暗条件下幼苗中表达量的2倍左右,蓝光、复合光和白光处理次之,黑暗和绿光条件下,该基因表达量最少(图 5B)。
3 讨论与结论DOPA5-GT是甜菜红色合成途径中关键基因,本研究对苋菜AmaDOPA5-GT基因进行生物信息学分析。多重比对发现AmaDOPA5-GT含有1个44个氨基酸残基组成的保守UDP结合位点[21, 22],说明该蛋白属于糖基转移酶家族成员。亚细胞定位结果表明AmaDOPA5-GT蛋白定位于细胞膜上,这可能与该蛋白的转移酶活性息息相关。
启动子分析结果表明AmaDOPA5-GT启动子含有大量的植物响应元件,其中最多的是光响应元件,说明光对AmaDOPA5-GT的调控起着重要的作用。为进一步研究光照对AmaDOPA5-GT表达的影响,对不同光质处理下该基因表达情况进行了研究。结果表明:在暗处理条件下,苋菜苷含量和AmaDOPA5-GT基因表达均显著降低,说明AmaDOPA5-GT基因表达的表达和苋菜苷的合成离不开光。在蓝光处理条件下,苋菜中AmaDOPA5-GT基因表达上调和苋菜苷含量增高,这说明短波长光源有利于色素的积累,这一点与Kishima等的结果相一致[23]。Göring[17]在苋菜愈伤的研究也发现蓝光促进苋菜苷的累积,而远红光反而可以逆转合成的色素。黄光和绿光处理条件下,AmaDOPA5-GT基因表达变化不大但苋菜苷含量显著降低,说明较长波长的光源对AmaDOPA5-GT基因表达的影响不大但却不利于苋菜苷的合成。在红光处理条件下,苋菜苷含量降低而AmaDOPA5-GT基因表达显著上调,AmaDOPA5-GT基因表达水平的提高可能是由苋菜苷含量减少引起的反馈调节。另外,光敏色素是红光的光受体,而光敏色素也是光调节色素累积的一个途径[24],这也可能是AmaDOPA5-GT基因在红光条件下的上调表达的原因。
以上结果表明,AmaDOPA5-GT基因在甜菜苷合成途径中发挥着重要的作用,其表达水平受光调控明显。另外本研究还发现短波长光源(如蓝光)对苋菜苷合成的促进作用可能是通过诱导AmaDOPA5-GT基因的表达实现的。本研究可为揭示AmaDOPA5-GT在苋菜苷合成中的作用奠定基础,并可为富含苋菜苷的苋菜育种提供线索。
| [1] | PEDERSEN B, KALINOWSKI L S, EGGUM B O. The nutritive value of amaranth grain (Amaranthus caudatus)[J]. Plant Food Hum Nutr, 1987, 36(4): 309-324.( 1) 1) |
| [2] | RASTOGI A, SHUKLA S. Amaranth: A new millennium crop of nutraceutical values[J]. Crit Rev Food Sci, 2013, 53(2): 109-125.( 1) 1) |
| [3] | ACHIGAN-DAKO E G, SOGBOHOSSOU O E D, MAUNDU P. Current knowledge on Amaranthus spp.: research avenues for improved nutritional value and yield in leafy amaranths in sub-Saharan Africa[J]. Euphytica, 2014, 197(3): 303-317.( 1) 1) |
| [4] | SOGBOHOSSOU O E D, ACHIGAN-DAKO E G. Phenetic differentiation and use-type delimitation in Amaranthus spp. from worldwide origins[J]. Sci Hortic-Amsterdam, 2014, 178: 31-42.( 1) 1) |
| [5] | CAI Y Z, SUN M, CORKE H. Characterization and application of betalain pigments from plants of the Amaranthaceae[J]. Trends Food Sci Tech, 2005, 16(9): 370-376.( 1) 1) |
| [6] | STRACK D, VOGT T, SCHLIEMANN W. Recent advances in betalain research[J]. Phytochemistry, 2003, 62(3): 247-269.( 2) 2) |
| [7] | GAND A-HERRERO F, GARC A-CARMONA F. Biosynthesis of betalains: yellow and violet plant pigments[J]. Trends Plant Sci, 2013, 18(6): 334-343.( 1) 1) |
| [8] | SAKUTA M. Diversity in plant red pigments: anthocyanins and betacyanins[J]. Plant Biotechnol Rep, 2014, 8(1): 37-48.( 2) 2) |
| [9] | WYLER H, MEUER U, BAUER J, et al. Cyclodopa glucoside (=(2S)-5-(β-D-glocopyranosyloxy)-6-hydroxyindoline-2-carboxylic acid) and its occurrence in red beet (beta vulgaris var. rubra L.)[J]. Helv Chim Acta, 1984, 67(5): 1348-1355.( 2) 2) |
| [10] | KOBAYASHI N, SCHMIDT J, WRAY V, et al. Formation and occurrence of dopamine-derived betacyanins[J]. Phytochemistry, 2001, 56(5): 429-436.( 1) 1) |
| [11] | SASAKI N, ADACHI T, KODA T, et al. Detection of UDP glucose: cyclo-DOPA 5-O-glucosyltransferase activity in four o'clocks (Mirabilis jalapa L.)[J]. Febs Lett, 2004, 568(1): 159-162.( 1) 1) |
| [12] | SASAKI N, ABE Y, WADA K, et al. Amaranthin in feather cockscombs is synthesized via glucuronylation at the cyclo-DOPA glucoside step in the betacyanin biosynthetic pathway[J]. J Plant Res, 2005, 118(6): 439-442.( 1) 1) |
| [13] | CASIQUE-ARROYO G, MART NEZ-GALLARDO N, DE LA VARA L G, et al. Betacyanin biosynthetic genes and enzymes are differentially induced by (a) biotic stress in Amaranthus hypochondriacus[J]. Plos One,2014, 9(6):e99012.( 3) 3) |
| [14] | SASAKI N, WADA K, KODA T, et al. Isolation and characterization of cDNAs encoding an enzyme with glucosyltransferase activity for cyclo-DOPA from four o'clocks and feather cockscombs[J]. Plant Cell Physiol, 2005, 46(4): 666-670.( 1) 1) |
| [15] | ZHAO S Z, SUN H Z, CHEN M, et al. Light-regulated betacyanin accumulation in euhalophyte Suaeda salsa calli[J]. Plant Cell Tiss Org, 2010, 102(1): 99-107.( 2) 2) |
| [16] | SHIN K S, MURTHY H N, HEO J W, et al. Induction of betalain pigmentation in hairy roots of red beet under different radiation sources[J]. Biol Plantarum, 2003, 47(1): 149-152.( 1) 1) |
| [17] | G RING H, D RFLER M. Amaranthin accumulation in continuous red and blue light by seedlings of Amaranthus caudatus L [J]. Biol Plantarum, 1981, 23(3): 193-197.( 2) 2) |
| [18] | LIU S, KUANG H, LAI Z. Transcriptome Analysis by Illumina High-Throughout Paired-End Sequencing Reveals the Complexity of Differential Gene Expression during In Vitro Plantlet Growth and Flowering in Amaranthus tricolor L[J]. Plos One,2014, 9:e100919.( 1) 1) |
| [19] | 刘生财, 匡华琴, 谢礼洋, 等. 苋菜试管苗 amaNACA 2-like 基因克隆及生物信息学分析[J]. 东北农业大学学报, 2014, 45(1): 83-89.( 2) 2) |
| [20] | 林丽霞, 屈莹, 徐洋, 等. 龙眼体胚发生过程生长素响应因子 DlARF5a 的克隆及表达分析[J]. 西北植物学报, 2014, 34(6): 1075-1082.( 2) 2) |
| [21] | VOGT T, GRIMM R, STRACK D. Cloning and expression of a cDNA encoding betanidin 5-O-glucosyltransferase, a betanidin- and flavonoid- specific enzyme with high homology to inducible glucosyltransferases from the Solanaceae[J]. Plant J, 1999, 19(5): 509-519.( 1) 1) |
| [22] | GACHON C M M, LANGLOIS-MEURINNE M, SAINDRENAN P. Plant secondary metabolism glycosyltransferases: the emerging functional analysis[J]. Trends Plant Sci, 2005, 10(11): 542-549.( 1) 1) |
| [23] | KISHIMA Y, SHIMAYA A, ADACHI T. Evidence that blue light induces betalain pigmentation in Portulaca callus [J]. Plant Cell Tiss Org, 1995, 43(1): 67-70.( 1) 1) |
| [24] | KÖHLER K H, DÖRFLER M, GÖRING H. The influence of light on the cytokinin content of Amaranthus seedlings [J]. Biol Plantarum, 1980, 22(2): 128-134.( 1) 1) |
 2015, Vol. 30
2015, Vol. 30
