2. 福建农林大学教育部重点实验室农业生态研究所, 福建 福州 350002
2. Key Laboratory of Crop Ecology and Molecular Physiology of Fujian Universities, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China
太子参又称孩儿参,是一种名贵中药材,在福建、贵州、江苏、安徽、山东、浙江等地多有种植。太子参含有挥发性物质、环肽类、糖类及酯类等化学成分,具有抗肿瘤、心肌保护、免疫增强、抗氧化、抗应激、治疗糖尿病及止咳等药理作用 [1],是儿科临床常用中药。20世纪70年代前,这种中药材主要是野生采集用以供应医药之需。之后,太子参主要由人工栽培获得,但是栽培此药材的过程中发生严重的连作障碍现象[2]。连作障碍已成为药用植物产量和品质提高的重要制约因素。根际是土壤与植物根系之间紧密结合的环境,同时也是土壤-根系-微生物三者紧密结合、相互影响的场所[3]。陈曦等[4]研究发现,不同产地和土壤类型的人参根际真菌在种群组成和优势种类方面存在不同。有研究表明药用植物产生的次级代谢产物(如黄酮、生物碱、萜类、蒽醌、酚类等)在药用植物生长过程中会被植物大量释放到土壤中,从而引起药用植物根际土壤理化性质的改变[5],这些变化将对药用植物的生长和有效成分的累积产生影响。根系分泌物是植物与根际微生物相互作用的中间媒介,同时其又为微生物提供重要的营养和能量来源,直接或间接影响着根际微生物的代谢和生长发育,进而对根际微生物的种类、数量和分布产生影响[6]。由此可见,引起连作障碍的原因与机制是错综复杂的,不可能单靠某种单一的技术,或者仅仅从某个单一的方面进行研究而达到揭示问题实质的目的。然而,要系统地认识太子参连作的根际生态机制,必须建立在充分了解“土壤-微生物-根际”相互关系的系统的层面上。因此,本研究主要通过联合采用Biolog微平板技术和磷脂脂肪酸(Phospholipid Fatty Acid,PLFA)分析技术,研究连作太子参根际土壤微生物的群落结构和功能多样性变化。
1 方法与材料 1.1 材料培养本研究选取‘柘荣太子参2号’为试验材料。田间种植为每垄种植4行,参苗间隔为5 cm,每个处理3个重复。菌肥处理如下:
(1)正茬:新地种植,不施菌肥。
(2)重茬:重茬地种植,不施菌肥。
(3)复合菌肥1:重茬地种植,在种植期间使用复合菌肥1处理。
(4)复合菌肥2:重茬地种植,在种植期间使用复合菌肥2处理。
(5)解淀粉:重茬地种植,在种植期间使用解淀粉芽孢杆菌菌肥处理。
其余肥料处理与当地传统施肥模式一致。于成熟期进行根际土壤取样,取样时先将整株太子参挖起,敲去边缘土以及表面土,再将根际附近的土壤用力抖落,再立刻将土碾碎过1 mm筛,之后将土壤用于下一步的试验。
1.2 Biolog技术研究根际土壤微生物群落结构和多样性称取5 g鲜土置高压灭菌后的三角瓶中,加入含0.85% NaCl的无菌水100 mL,封口,120 r·min-1振荡30 min,冰浴中静置2 min。取上清液5 mL置100 mL灭菌三角瓶中加入45 mL无菌水,重复稀释3次,制得1∶1 000的提取液。将Biolog平板预热到28℃,用移液器取150 μL提取液于各孔中,28℃恒温避光培养,在第1、2、3、4、5、6和7 d用ELISA反应平板读数器读取590 nm的吸光值。Biolog微平板每孔颜色平均变化率(average well color development,AWCD)表示土壤微生物群落ELISA反应,它是检验微生物生理活动强度的一个重要指标。AWCD=[∑(C-R)]/N,其中C是所测定31个碳源孔的吸光值,R为对照孔的吸光值,N为碳源的数目。
1.3 PLFA技术研究根际土壤微生物群落结构和多样性PLFA的提取过程参考Frostegard方法[7]。取5 g土样于50 mL离心管中,加入20 mL的0.2 mol·L-1的KOH甲醇溶液,漩涡震荡10 min后在37℃水浴锅中温育1 h,使其充分酯化。加入3 mL的1 mol·L-1醋酸溶液用于中和溶液pH值。加入10 mL正己烷,旋涡震荡10 min使磷脂脂肪酸转移到有机相中,3 000 r·min-1离心15 min。立即将上层澄清的正己烷转到干净的玻璃试管中,使其在氮气流下吹干,加入1 mL的正己烷∶甲基叔丁基醚为1∶1的溶液,充分溶解3~5 min,获得的溶液过0.22 μm的有机滤头。所有试验样品均设3个重复。GC-MS仪器分析分析采用CP8944 柱,二阶程序升温,起始温度为70℃,以20℃·min-1升至170℃,维持2 min,而后5℃·min-1升至280℃,维持5 min,最后以40℃·min-1升至最高温度300℃,维持1.5 min。气化室温度250℃,检测器温度300℃,载气为H2(2 mL·min-1)、尾气为N2(30 mL·min-1),柱前压10.00 psi(1 psi=6.895 kPa);进样量1 μL,进样分流比100∶1。
2 结果与分析 2.1 Biolog技术分析不同菌肥处理下太子参根际土壤微生物区系变化 2.1.1 不同菌肥处理的土壤微生物群落平均颜色变化率(AWCD)在培养开始后,每隔24 h测定1次AWCD值,得到其随时间变化的动态图(图1)。随着培养时间的延长,微生物对碳源的利用量增加,在24 h内平均吸光值较低,24 h后,AWCD急剧升高,到96 h时基本上趋于稳定,说明24~96 h碳源被迅速利用。不同处理中,正茬处理的AWCD值最高,土壤微生物群落对底物碳源的利用能力显著高于其他处理。与重茬相比和解淀粉相比,复合菌肥1和复合菌肥2处理下的AWCD值较低,说明其土壤中微生物群落能利用碳源的能力降低。因此,本研究进一步对基于96 h的微生物对碳源的具体利用情况进行研究。
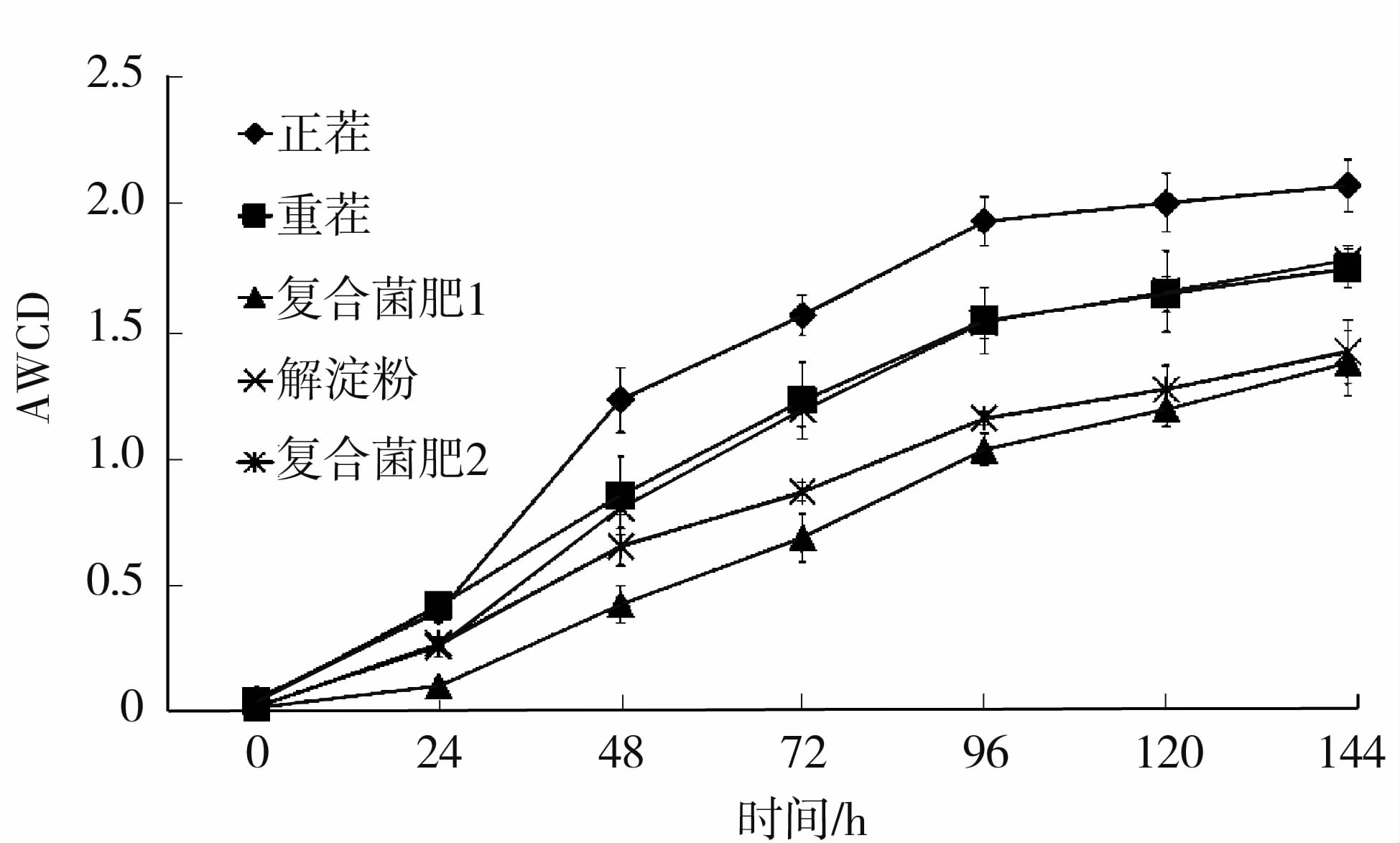
|
图1 5种不同土壤的微生物群落平均颜色变化率随时间的动态变化 Fig.1 Average well colour development (AWCD) in five different soils |
BIOLOG板上的31种碳源可分成6大类,即羧酸类、多聚物、糖类、酚酸类、氨基酸类、腐胺类。通过不同处理的土壤微生物对6种主要碳源类型利用程度的分析(图2)可知,根际土壤微生物对不同碳源利用程度存在着显著差异。与重茬相比较,不论是哪种碳源,复合菌肥1和复合菌肥2处理下的土壤微生物对其利用程度都是降低的,尤其是对酚酸类的利用程度,甚至都没有重茬的一半。但是解淀粉处理的土壤微生物对碳源利用程度几乎与重茬的一致。
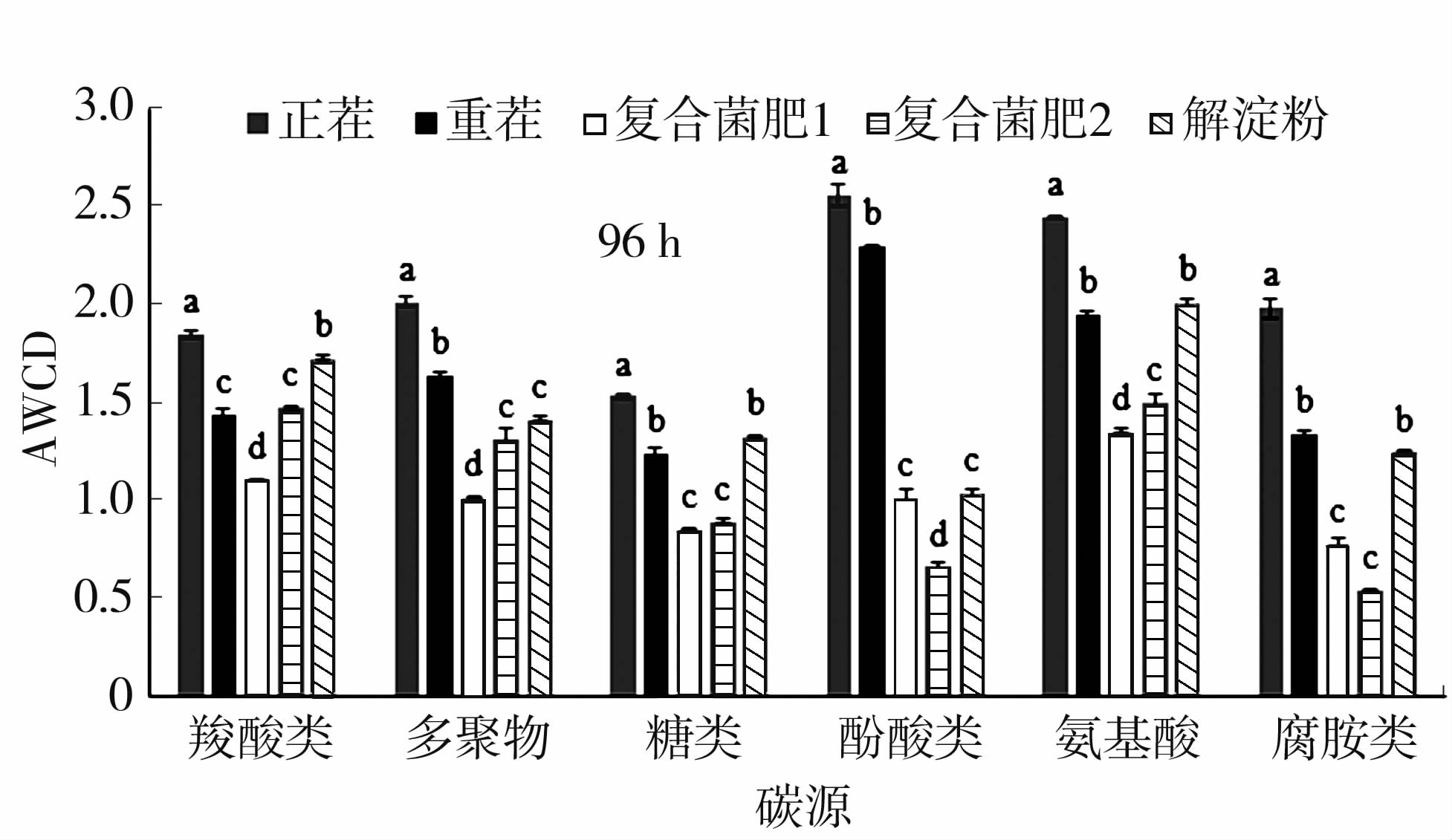
|
图2 基于96 h的5种太子参根际土壤微生物对不同类型碳源利用情况的平均颜色变化率(AWCD) 注:不同小写字母表示同一碳源不同菌肥处理间差异显著(P<0.05)。 Fig.2 Categorized substrates utilization pattern of five different soils sampled at the 96h |
基于培养96 h的AWCD值,运用SPSS11.5软件对5种土壤微生物利用单一碳源特性进行主成分分析(如图3、表1)。从图3(左)可以看出,正茬和重茬土位于主成分1的正端,主成分2的负端,但是位置相距较远。解淀粉土位于主成分1的正端,主成分2的正端,复合菌肥1和复合菌肥2主成分1的负端,主成分2的负端,位置几乎一致。可见,主成分1、主成分2基本能够区分不同菌肥处理的太子参根际土壤微生物群落特征及其对碳源的利用特征,说明不同菌肥处理的太子参根系分泌物的种类及组成有较大差异,从而影响了其根际微生物的群落分布及功能多样性。
| 表1 主成分的解释变量 Tab. 1 Value of principal component analysis |
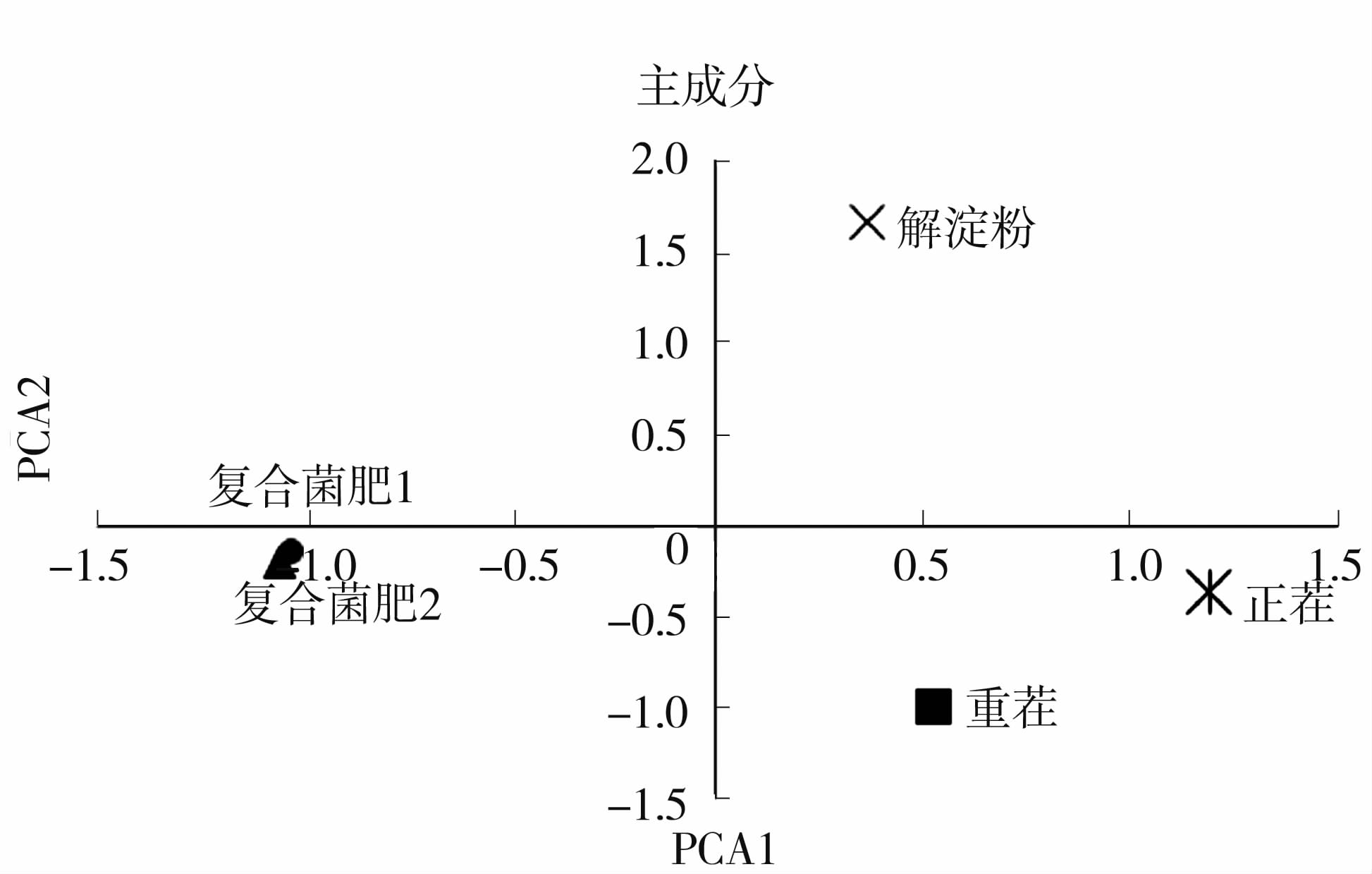
|
图3 培养96 h不同菌肥处理的太子参根际土壤微生物碳源利用的主成分分析 Fig.3 The principal component analysis (PCA) of carbon utilization profiles by soil microbe after cultured for 96 h |
同时,从表1可以看出,第一主成分PCA1 解释变量方差的42.901%,其对群落的贡献大于PCA2、PCA3和PCA4。PCA2解释变量方差的25.101%,PCA3解释变量方差的19.801%,PCA3解释变量方差的12.197%。PCA1和PCA2累计贡献率为68.002%。说明提取的PCA1和PCA2主成分可以大部分概括土壤微生物对6类碳源的利用信息。
2.2 PLFA技术分析不同处理下太子参根际土壤微生物变化 2.2.1 PLFA技术分析太子参连作对根际土壤微生物群落结构的影响从表2可以看出,提取的主成分1和主成分2的解释变量方差的78.632%。主成分分析表明,4种不同土壤的微生物群落结构可被主成分2(PCA2)明显区分,其中正茬土壤位于主成分2(PCA2)的右边,而重茬、复合菌肥1、复合菌肥2和解淀粉位于PCA2的左边(图4)。进一步分析表明,重茬处理与解淀粉之间的主成分相近,而复合菌肥1和复合菌肥2之间的主成分相近,与本研究前期得到产量的趋势相同。
| 表2 主成分的解释变量 Tab. 2 Value of principal component analysis |
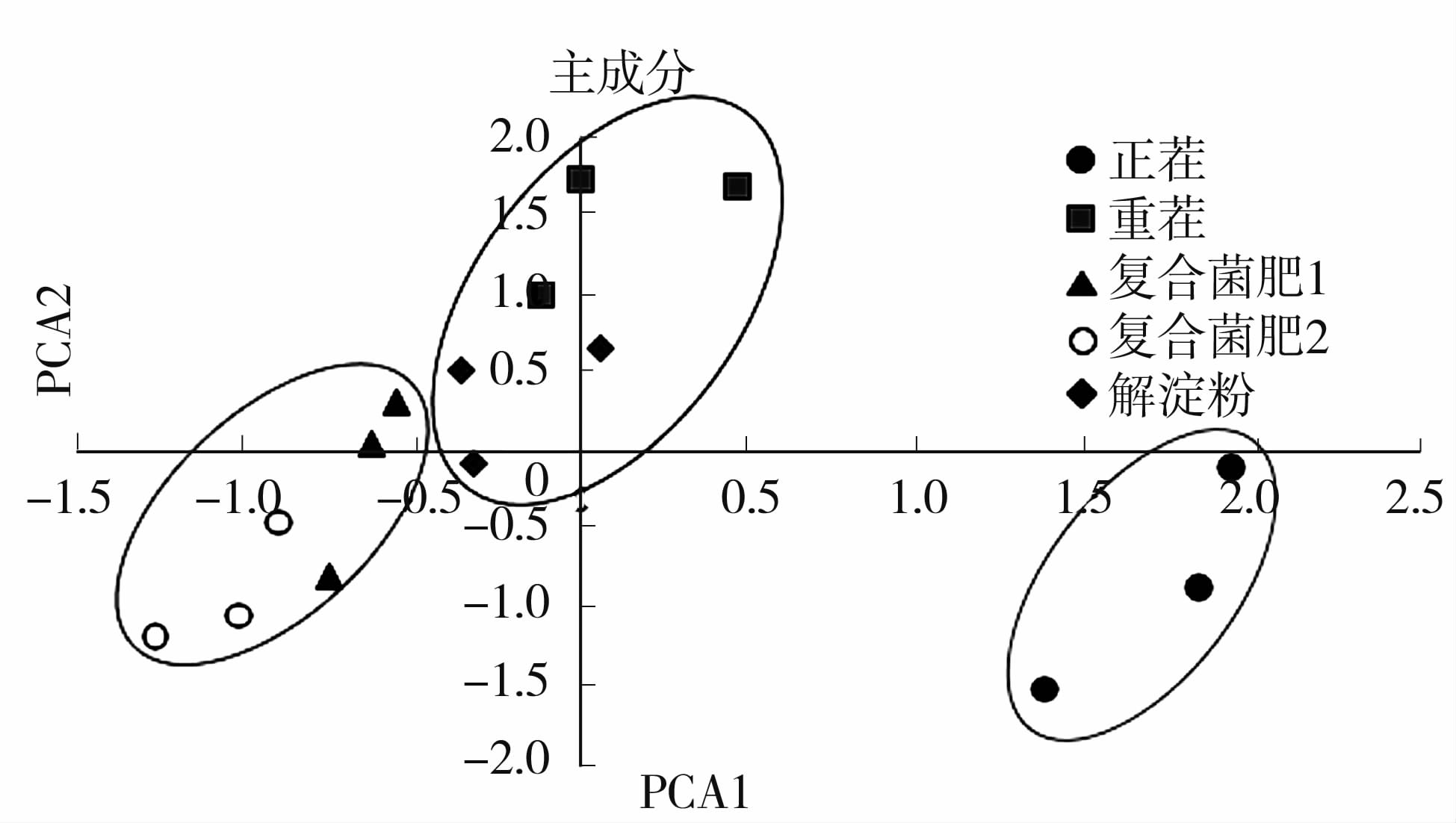
|
图4 不同菌肥处理下太子参根际土壤微生物群落PLFA主成分分析 Fig.4 Principle components analysis of PLFA profiles from soil microbial communities of different length of continuous cropping |
聚类分析表明,重茬土壤与解淀粉土壤的微生物群落结构更为接近,而复合菌肥1和复合菌肥2的土壤微生物群落结构较为相似并明显区别于正茬土壤(图5)。
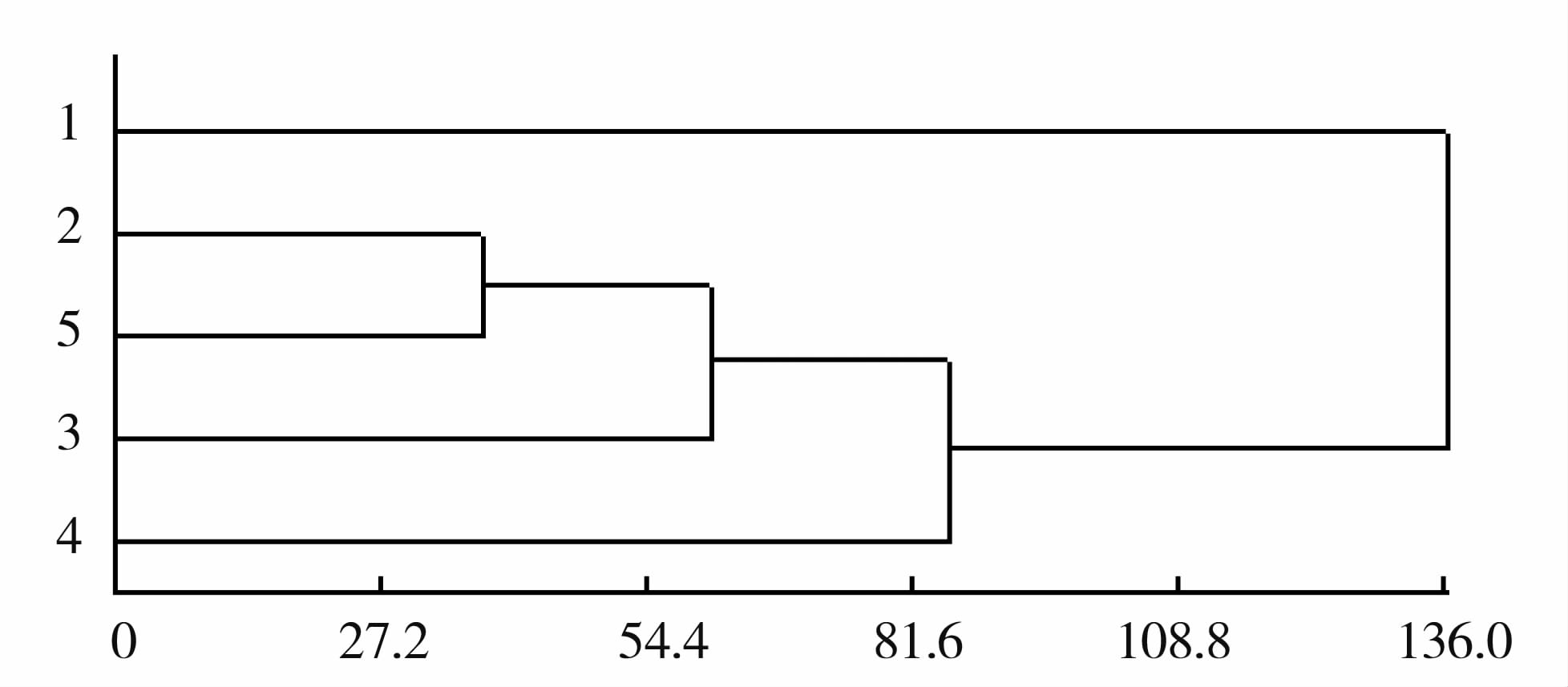
|
图5 PLFA数据聚类分析 注:1代表正茬;2代表重茬;3代表复合菌肥1;4代表复合菌肥2;5代表解淀粉 Fig.5 Classification of treatments by cluster analysis with PLFA data |
土壤中磷脂脂肪酸的组成可以表示土壤微生物群落的生物量和结构 [8]。一些学者曾发现,使用直接从土壤中提取的磷酯类化合物的量可准确地表达出土壤微生物的生物量。本试验从不同菌肥处理的太子参根际土壤中共提取到17种不同的PLFAs生物标记,指示着不同类群的微生物,包括细菌、真菌、放线菌、原生生物等(表3)。5种主要微生物类群其PLFA含量在所有土壤样品中都呈现相同的变化趋势:革兰氏阳性菌(G+)>真菌>革兰氏阴性菌(G-)>放线菌>细菌。
| 表3 不同菌肥处理的太子参根际土壤磷脂脂肪酸含量 Tab. 3 List of identified PLFAs and their mean abundancein five different treatments |
同时,在所有土壤样品中,G+/G-比例都大于1,这表明太子参根际土壤中革兰氏阳性菌(G+)含量稳定高于革兰氏阴性菌(G-)。进一步分析发现,在不同菌肥处理对土壤微生物总量、细菌、真菌、放线菌、G+和G-含量都有显著影响。正茬土壤中的大部分菌群的PLFA标记物(如16∶1w7c、cy17∶0w、cy19∶0w、20∶1w9c、i14∶0w、i15∶0w、i16∶1w5c、i17∶0w、10Mel16∶0w、10Mel17∶0w、10Mel18∶0w、15∶0w)含量都显著高于重茬土壤和其余3种菌肥处理的土壤。但是各个处理间也有部分的PLFA标记物含量差异不显著(如i16∶1w5c、18∶1w9c、18∶3w6c)。其中正茬土壤的根际土壤的PLFA总量、革兰氏阳性菌(G+)、革兰氏阴性菌(G-)、真菌、细菌和放线菌的含量都明显高于重茬和其余3种菌肥处理的土壤。而重茬2年真菌含量与正茬土壤差异不显著。但是,重茬土壤的PLFA总量和解淀粉处理的PLFA总量之间没有差异,并且显著高于复合菌肥1和复合菌肥2处理的PLFA总量。土壤微生物在代谢胁迫时会积累特殊脂肪酸 [8],分析这些生物标记物可以帮助了解逆境微生物群落的原位组成。本研究发现,重茬和解淀粉土壤的环丙烷磷脂脂肪酸(cy17∶0w)与其代谢前提物(16∶1w7c)的比例(cy/pre)显著高于复合菌肥1和复合菌肥2土壤。cy/pre比例可用于表征逆境微生物群落生理应激压力,说明太子参连作下土壤微生物群落受到了一定程度的代谢胁迫。
总而言之,不同菌肥处理对相关微生物类群的生长有着重要的影响。正茬的PLFA总量最高,重茬与解淀粉次之,复合菌肥1与复合菌肥2最低,这与BIOLOG数据的变化趋势表现一致。
3 讨论与结论连作障碍是药用植物栽培过程中的一种常见现象,而造成连作障碍的可能原因有土壤营养失衡、自毒物质积累和土传病害等[9]。近年来,有关植物-微生物根际的研究引起了国内外研究者们的广泛关注,而二者之间的互作关系对土壤质量、作物健康以及品质产量都有重要作用[10]。植物根系分泌物作为根际对话的主要调控者,对土壤微生物群落结构有显著影响[11]。BIOLOG结果表明,正茬土壤的微生物利用碳源的情况与重茬土壤以及其余3种菌肥之间存在显著差异(图1)。有研究表明,根系分泌物的释放与植物所处的环境密切相关,它是植物响应外界胁迫的重要载体物质[12]。根系分泌物的化学组成和含量因植物种类、生长发育期不同以及环境因子胁迫而改变,而且根际微生物群落结构会随之发生变化[13]。在不同菌肥处理下,正茬土壤的微生物对各种不同碳源的利用程度均最高,这可能与太子参响应非生物、生物胁迫后合成释放更多的化学应答物质有关。与重茬相比较,不论是哪种碳源,复合菌肥1和复合菌肥2处理下的土壤微生物对其利用程度都是降低的,尤其是对酚酸类(如2-羟基苯甲酸和4-羟基苯甲酸)的利用程度,甚至都没有重茬的一半。本研究前期田间试验观察发现,在太子参膨大期,正茬与重茬地块上的太子参植株生长尤其是地下部根生长情况开始出现差异,尤其到了成熟期时,太子参的重茬地上部基本上都枯萎变黄,说明此时的根系分泌活动可能也已发生重大改变,进而引起土壤微生物群落结构和功能多样性变化。在经过菌肥复合菌肥1和复合菌肥2修复后太子参产量相对于重茬显著增加,而解淀粉的产量不但没有增加甚至还有下降的趋势,这都与BIOLOG的趋势一致。
磷脂是所有生物活细胞重要的膜组分,在真核生物和细菌的膜中磷脂分别约占50 %和98 %。根据磷脂脂肪酸的种类和比例来鉴别土壤微生物群落结构和功能的多样性[14, 15, 16]。本研究进一步利用磷脂脂肪酸法(PLFA)对微生物群落结构进行分析,发现在不同菌肥处理下正茬土壤的微生物PLFA总量、细菌、真菌、放线菌、G+和G-含量显著高于其他几个处理。重茬和解淀粉的PLFA总量、细菌、革兰氏阳性菌(G+)、革兰氏阴性菌(G-)和真菌含量都明显高于复合菌肥1土壤和复合菌肥2土壤,这与BIOLOG变化趋势类似。前人研究表明,单不饱和磷脂脂肪酸即代谢前体物(18∶1w7c)转变成稳定的环丙烷磷脂脂肪酸(cy17∶0)更有利于微生物在逆境胁迫下维持其细胞膜的功能活性[17, 18, 19, 20, 21]。在不同菌肥处理下重茬和解淀粉的cy/pre比例增加,说明这2种土壤微生物群落受到了一定程度的代谢胁迫或生理应激压力。
BIOLOG和PLFA分析表明,在不同菌肥处理下,太子参根际土壤微生物群落结构和碳源代谢多样性都发生显著变化。通过BIOLOG试验发现,在不同菌肥处理下,正茬土壤的微生物对各种不同碳源的利用程度均最高。然而与重茬相比较,不论是哪种碳源,复合菌肥1和复合菌肥2处理下的土壤微生物对其利用程度都是降低的,尤其是对酚酸类的利用程度,甚至都没有重茬的一半。本研究进一步利用磷脂脂肪酸法(PLFA)对微生物群落结构进行分析,发现在不同菌肥处理下正茬土壤的微生物PLFA总量、细菌、真菌、放线菌、G+和G-含量显著高于其他几个处理。重茬和解淀粉的PLFA总量、细菌、革兰氏阳性菌(G+)、革兰氏阴性菌(G-)和真菌含量都明显高于复合菌肥1土壤和复合菌肥2土壤,这与BIOLOG变化趋势类似。同时,在不同菌肥处理下重茬和解淀粉的cy/pre比例增加,说明这2种土壤微生物群落受到了一定程度的代谢胁迫或生理应激压力。但是对于这种应激压力源自何处,它如何介导土壤微生物群落结构变化等尚不清楚,需进一步研究。
| [1] | 蔡巧燕, 林珊, 肖桂清,等. 太子参内生真菌体外抗肿瘤、抗氧化活性研究[J].福建中医药大学学报, 2011,(6): 41-43.( 1) 1) |
| [2] | 徐立, 陶玲, 喻斌,等. 太子参多糖对LPS诱导原代培养心肌细胞损伤的保护作用[J]. 中药药理与临床, 2008,(6): 46-48.( 1) 1) |
| [3] | HU J, PANG W, BAI S,et al. Hypoglycemic effect of polysaccharides with different molecular weight of Pseudostellaria heterophylla[J]. Bmc Complem Alternm, 2013, 13(1): 267.( 1) 1) |
| [4] | PANG W, LIN S, DAI Q,et al. Antitussive activity of pseudostellaria heterophylla (Miq.) pax extracts and improvement in lung function via adjustment of multi-cytokine levels[J]. Molecules, 2011, 16(4): 3360-3370.( 1) 1) |
| [5] | 夏品华, 刘燕. 太子参连作障碍效应研究[J]. 西北植物学报, 2010,(11): 2240-2246.( 1) 1) |
| [6] | 曾令杰, 林茂兹, 李振方, 等. 连作对太子参光合作用及药用品质的影响[J]. 作物学报, 2012,(8): 1522-1528.( 1) 1) |
| [7] | BUTLER J L, WILLIAMS M A, BOTTOMLEY P J,et al. Microbial community dynamics associated with rhizosphere carbon flow[J]. Appl Environ Microb, 2003, 69(11): 6793-6800.( 1) 1) |
| [8] | 陈曦, 孙晓东, 毕思远, 等. 东北地区人参根际土壤真菌多样性研究[J]. 安徽农业科学, 2010,(10): 5515-5517.( 2) 2) |
| [9] | NIHORIMBERE V, ONGENA M, SMARGIASSI M,et al. Beneficial effect of the rhizosphere microbial community for plant growth and health[J]. Biotechnol Agron Soc Environ, 2011, 15(2): 327-337.( 1) 1) |
| [10] | NIHORIMBERE V, ONGENA M, SMARGIASSI M, et al. Beneficial effect of the rhizosphere microbial community for plant growth and health[J]. Biotechnol Agron Soc Environ, 2011, 15,(2): 327-337.( 1) 1) |
| [11] | FROSTEGÅRD Å, TUNLID A, BÅÅTH E. Phospholipid fatty acid composition, biomass, and activity of microbial communities from two soil types experimentally exposed to different heavy metals[J]. Appl Environ Microb, 1993, 59(11): 3605-3617.( 1) 1) |
| [12] | FROSTEGÅRD Å, BÅÅTH E, TUNLIO A. Shifts in the structure of soil microbial communities in limed forests as revealed by phospholipid fatty acid analysis[J]. Soil Biology and Biochemistry, 1993, 25(6): 723-730.( 1) 1) |
| [13] | VESTAL J R, WHITE D C. Lipid analysis in microbial ecology[J]. Bioscience, 1989: 535-541.( 1) 1) |
| [14] | KIEFT T L, RINGELBERG D B, WHITE D C. Changes in ester-linked phospholipid fatty acid profiles of subsurface bacteria during starvation and desiccation in a porous medium[J]. Appl Environ Microb, 1994, 60(9): 3292-3299.( 1) 1) |
| [15] | 张重义, 李明杰, 陈新建,等. 地黄连作障碍机制的研究进展与消减策略. 中国现代中药, 2013(1): 38-44.( 1) 1) |
| [16] | MARSCHNER P. Plant-microbe interactions in the rhizosphere and nutrient cycling. Nutrient cycling in terrestrial ecosystems: Springer, 2007:159-182.( 1) 1) |
| [17] | BERENDSEN R L, PIETERSE C M, BAKKER P A. The rhizosphere microbiome and plant health[J]. Trends Plant Sci, 2012, 17(8): 478-486.( 1) 1) |
| [18] | CHAPARRO J M, BADRI D V, BAKKER M G,et al. Root exudation of phytochemicals in Arabidopsis follows specific patterns that are developmentally programmed and correlate with soil microbial functions[J]. PLoS One, 2013, 8(2): e55731.( 1) 1) |
| [19] | DOORNBOS R F, VAN LOON L C, BAKKER P A. Impact of root exudates and plant defense signaling on bacterial communities in the rhizosphere. A review[J]. Agron Sustain Dev, 2012, 32(1): 227-243.( 1) 1) |
| [20] | 颜慧, 蔡祖聪, 钟文辉. 磷脂脂肪酸分析方法及其在土壤微生物多样性研究中的应用[J]. 土壤学报, 2006,(5): 851-859.( 1) 1) |
| [21] | ALIASGHARZAD N, MåRTENSSON L, OLSSON P A. Acidification of a sandy grassland favours bacteria and disfavours fungal saprotrophs as estimated by fatty acid profiling[J]. Soil Biology and Biochemistry, 2010, 42(7): 1058-1064.( 1) 1) |
 2015, Vol. 30
2015, Vol. 30
