胭脂李Prunus salicina Lindl.CV.Yanzhi,是福建早熟鲜食优良李果品种,其果皮、果肉均为紫红色,肉质较软、汁多、味甜微酸可口,在福建、广西等地区广泛种植,全国栽培面积0.13万多hm2,年产鲜果1万多t[1, 2]。胭脂李果实营养丰富,含有花青素多酚类物质、多糖、维生素C、有机酸、氨基酸、矿物质等营养活性成分,其中γ-氨基丁酸含量比其他闽产李果品种更高[3, 4];每100 g 新鲜胭脂李果实多酚含量高达300 mg GAE以上,比苹果、香蕉、猕猴桃、葡萄等水果果实更高[5]。而多酚类物质已被证明具有抗氧化及预防癌症和心血管疾病等功效[6]。目前关于胭脂李研究主要集中在栽培技术[7]、营养成分分析[4, 8, 9]、花色素苷提取工艺[10]等方面,而对于胭脂李多酚分离纯化及其对黄嘌呤氧化酶的抑制作用尚未见报道。
高尿酸血症及痛风是当今社会的常见病、多发病,至今无法根治,研究表明长期高尿酸血症与高血压、糖尿病、冠心病、肾衰竭等密切相关[11, 12]。黄嘌呤氧化酶是介导尿酸生成的重要酶,黄嘌呤氧化酶抑制剂可通过抑制黄嘌呤氧化酶的活性,减少黄嘌呤及次黄嘌呤向尿酸盐的转化,从根本上减少尿酸的生成,从而达到治疗痛风的目的。在临床上抑制黄嘌呤氧化酶的药物包括别嘌呤醇、非布司他等,这些西药治疗虽然见效快,但副作用大,使其应用受到明显限制。如别嘌呤醇用后,病人会引起发热、腹痛、腹泻、过敏性皮疹、白细胞及血小板减少,甚至有肝功能损害等副作用[11, 12, 13, 14] 。
胭脂李在鲜食商品果的包装加工过程中,会摒弃小果、异形果、裂纹果等副产物,这些副产物占总产量的10%以上,未得到有效利用。本试验以胭脂李鲜食商品果筛选后的小果、异形果等副产物为研究对象,研究胭脂李多酚分离纯化工艺参数,探索胭脂李多酚对黄嘌呤氧化酶的抑制作用,以期为胭脂李副产物资源综合利用及其降尿酸产品开发应用提供理论依据。
1 材料与方法 1.1 原料与试剂胭脂李:来自福建省永泰县,为胭脂李鲜食商品果筛选后的小果、异形果等非商品等外果,七八成熟;经清洗,50℃热风干燥至含水率小于15%,粉碎,过筛(20目),贮藏于-20℃冰箱备用。
没食子酸标准品:上海源叶生物科技公司;黄嘌呤:纯度≥98%,上海源叶生物科技有限公司;黄嘌呤氧化酶,上海源叶生物科技有限公司;尿酸,含量99.0%,国药集团化学试剂有限公司;别嘌醇:纯度98%,上海源叶生物科技有限公司;其他试剂均为国产分析纯。
大孔树脂: AB-8购自上海源叶生物科技公司,HP-20购自北京索莱宝科技有限公司,其他树脂购自天津市海光化工有限公司,各树脂的物理特性见表 1。
| 表 1 大孔吸附树脂的物理特性 Table 1 Physical properties of macroporous resin |
R250B旋转蒸发器:上海申生科技有限公司;765P紫外可见分光光度计:上海光谱仪器有限公司;FD-1C-50型真空冷冻干燥机:北京博医康实验仪器有限公司;KQ-600DV数控超声波清洗器:昆山市超生仪器有限公司;玻璃层析柱:Φ25 mm×150 mm,上海沪西分析仪器设备公司;LC-600高效液相色谱仪:南京科捷分析仪器有限公司。
1.3 试验方法 1.3.1 胭脂李多酚粗提液制备工艺在带塞三角瓶中加入胭脂李、60%乙醇(v/v),置于超声波清洗器中提取,提取参数为:料液比[物料质量(g)与乙醇溶液体积(mL)的比例]1∶20、超声波提取时间30 min、超声波功率420 W、提取温度50℃,提取率达42 mg没食子酸当量/g干物质;然后将提取液抽滤,40℃减压浓缩至无醇味后备用。
1.3.2 总酚含量测定[15]以没食子酸作为标准物,采用Foin-Ciocaheu法测定总酚含量。取200 μL样品,加入2.5 mL 10%(v/v)福林酚溶液,充分摇匀,避光,在室温下培养2 min,加入质量浓度为75 g·L-1的Na2CO3溶液2 mL,混匀,用蒸馏水定容至刻度,50℃水浴15 min,快速冷却至室温,以相应试剂为空白,在765 nm波长处测定吸光度。多酚质量浓度以每mL样液中所含的没食子酸当量(mg·mL-1)表示。
1.3.3 大孔树脂预处理大孔树脂经95%乙醇浸泡48h,用蒸馏水洗至无醇味,4%HCl 浸泡6h,4%NaOH 浸泡24 h;最后再用蒸馏水洗至洗出液的pH 值达到中性,将树脂湿态保存。
1.3.4 静态吸附解吸试验分别称取5.0g 各种型号大孔树脂(D101、HP-20、AB-8、DA-201)于锥形瓶内,加入稀释一定倍数的李果多酚稀释液20 mL,放置24 h。放置前先测定多酚含量C0,24 h 后,吸取上清液,测量其吸附后的多酚含量C1;倒去上层清液,加入60%乙醇20 mL,放置24 h 然后吸取上清液,测量其解吸后的多酚含量C2吸附量Q、吸附率A、解吸量D和解吸率P如下式计算:
| $Q = \left[{\left( {{C_0} - {C_1}} \right) \times {V_1}} \right]/m$ | (1) |
| $A = \left[{\left( {{C_0} - {C_1}} \right)/{C_0}} \right] \times 100\% $ | (2) |
| $D = \left[{\left( {{C_2} \times {V_2}} \right)/m} \right] \times 100\% $ | (3) |
| $P = \left[{\left( {{C_2} \times {V_2}} \right)/\left( {Q \times m} \right)} \right] \times 100\% $ | (4) |
式中:Q为每g树脂吸附多酚的质量,mg·g-1;C0为吸附前供试液中胭脂李多酚的质量浓度,mg·mL-1;C1为吸附后供试液中胭脂李多酚的质量浓度,mg·mL-1;V1为供试液体积,mL;m为树脂湿重,g;D为每g树脂吸附出多酚的质量,mg·g-1;P为解吸率,%;C2为解吸液中多酚的质量浓度,mg·mL-1;V2为解吸液体积,mL。
1.3.5 动态吸附与解吸试验将预处理的HP-20树脂装入玻璃层析柱中,柱床体积BV为70 mL,用3 BV乙醇过柱洗涤后,用2 mL·min-1水平衡10 h。
动态吸附条件优化:(1)上样液质量浓度对吸附效果的影响:分别取150 mL质量浓度分别为0.5、1.0、1.5、2.0、2.5 mg·mL-1的多酚提取液,自然pH,以2 mL· min-1的流速通过层析柱,计算吸附率;(2) 上样流速对吸附效果的影响: 将质量浓度为1.0 mg·mL-1的样品液,在自然pH 3.23条件下,各取250 mL,分别以1、2、3、4、5 mL· min-1流速通过层析柱,计算吸附率。
动态解吸条件优化: 150 mL质量浓度为2 mg·mL-1胭脂李多酚上样液以2 mL· min-1速率上样,3BV去离子水洗脱,解吸液体积为3BV条件下,(1) 乙醇体积分数对于解吸效果的影响:研究体积分数为20%、40%、60%、80%、100%的乙醇以2 mg·mL-1流速解吸对于解吸率的影响;(2)解吸流速对于解吸效果的影响:研究流速分别为1、2、3、4、5 mL·min-1,体积分数为80%乙醇对于解吸率的影响。
1.3.6 黄嘌呤氧化酶抑制活性试验[16]将冻干后的多酚样品先少量DMSO溶解,再用磷酸缓冲盐溶液(0.2 mol·L-1,pH 7.5)稀释至不同浓度,在96孔酶标板中依次加入50 μL样品与150 μL 0.4 mmol·L-1黄嘌呤,35℃保温5 min,再加入50 μL 0.05 U·mL-1黄嘌呤氧化酶,反应25 min后以80 μL 1 mol·L-1 HCI终止反应;每个样品做3个平行,以磷酸缓冲盐溶液替代样品作为空白对照组。取反应液用超纯水稀释10倍,过0.25μm水性膜,用高效液相色谱法检测尿酸生成量,色谱柱为C18柱(5 μm,4.6(250 mm),液相条件:洗脱液体积分数为15%甲醇 + 85% 0.015 mol·L-1磷酸二氢胺溶液,进样体积为20 μL,流速0.8mL·min,检测波长为295 nm,运行时间10 min。
2 结果与分析 2.1 胭脂李多酚类物质的静态吸附 2.1.1 大孔树脂对胭脂李酚类物质的静态吸附和解吸性能试验大孔吸附树脂具有良好选择性、吸附容量大和易于再生等优点,被广泛用于分离植物多酚中,但大孔树脂的极性类别和多孔立体结构(如比表面积、孔径等)与其吸附和解吸特性密切相关[17, 18]。比较4种不同型号大孔树脂对胭脂李酚类物质的吸附、解吸性能,如表 2所示,4种大孔树脂对胭脂李多酚的吸附量的顺序依次是:HP-20> AB-8> DA-201> D101,吸附率都达到80%以上;4种大孔树脂解吸率差异较大,D101解吸率最小,AB-8、HP-20 和DA-201解吸率都达到70%以上。选择AB-8和HP-20进一步研究静态吸附和解吸能力。
| 表 2 不同型号大孔树脂静态吸附和解吸能力比较 Table 2 Static adsorption and desorption of various macroporous resins |
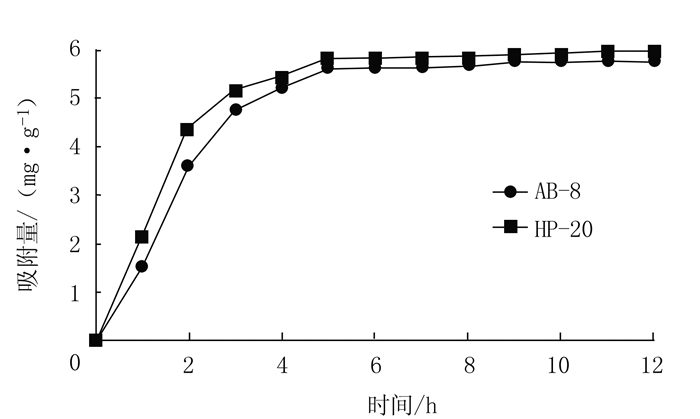
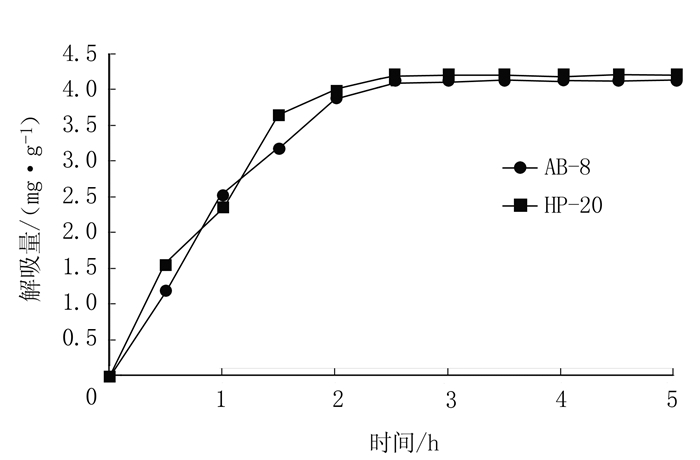
从图 1可知,AB-8和HP-20大孔树脂的吸附均为快速平衡型,起始阶段吸附量都较大;且树脂的吸附速率随时间的增加而急剧下降,然后慢慢趋向饱和,6 h后均基本达到平衡,从总体上看HP-20型树脂的吸附量始终优于AB-8树脂。图 2可以看出,AB-8和HP-20解吸在2 h后均基本达到平衡,HP-20洗脱速率更快。
|
图 1 AB-8和HP-20大孔树脂静态吸附曲线 Fig. 1 Static adsorption of AB-8 and HP-20 macroporous resins |
|
图 2 AB-8和HP-20大孔树脂静态解吸曲线 Fig. 2 Static desorption of AB-8 and HP-20 macroporous resins |
因此,综合考虑各树脂对胭脂李多酚的吸附率和解吸率,选取 HP-20型大孔树脂作为吸附分离胭脂李多酚的树脂。
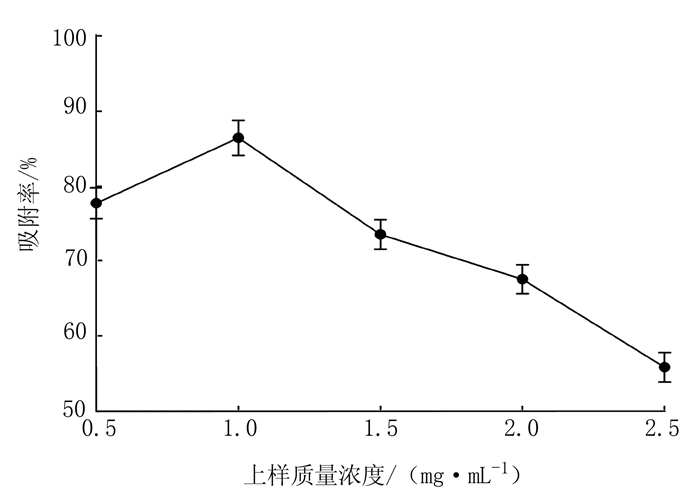
2.2 HP-20型树脂对胭脂李多酚类物质的动态吸附 2.2.1 上样液质量浓度对吸附效果的影响上样质量浓度影响大孔树脂对多酚的吸附效果,从图 3可知,胭脂李多酚质量浓度在0.5~2.5 mg·mL-1范围内,随着上样液质量浓度的增加,吸附率增大,1.0 mg·mL-1时达到最高吸附率,继续提高质量浓度,吸附率明显降低。这可能是因为胭脂李多酚上样浓度较低时,提高浓度可增加与树脂的接触吸附量,浓度过高,上样液中的糖类物质等杂质与多酚竞争吸附,导致HP-20树脂对多酚的特异性吸附能力减弱。因此,上样液质量浓度控制在1.0 mg·mL-1。
|
图 3 上样质量浓度对胭脂李多酚的吸附效果的影响 Fig. 3 Effect of feeding solutionconcentration on polyphenol adsorption of resin |
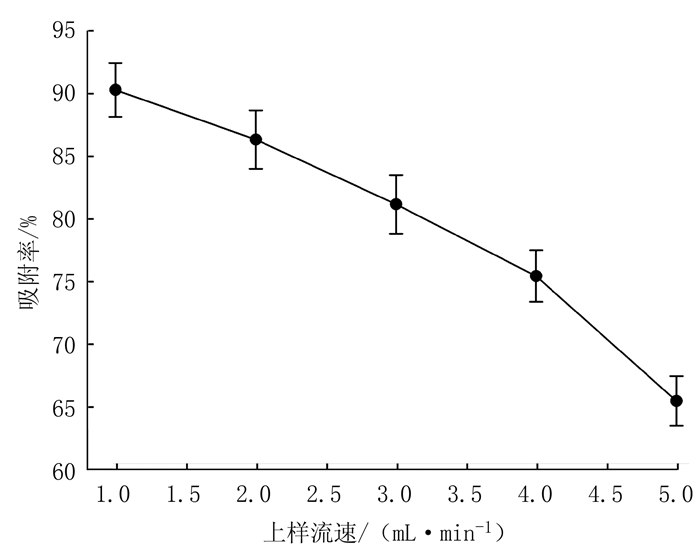
如图 4所示,随着胭脂李多酚上样液流速增大,大孔树脂的吸附率逐渐减少。可能是因为流速过大,多酚类物质还未扩散到大孔树脂表面,被大孔树脂吸附就流出树脂柱,从而导致吸附率降低,然而流速过低影响吸附效率,因此综合考虑,上样流速选择2 mL·min-1。
|
图 4 上样流速对胭脂李多酚的吸附效果的影响 Fig. 4 Effect of solution loading rate on polyphenol adsorption of resin |
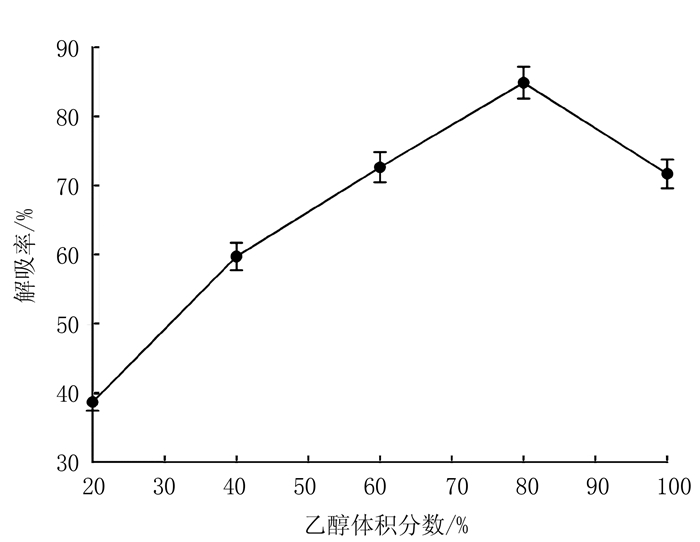
乙醇洗脱剂浓度对胭脂李多酚的洗脱效果如图 5所示,随乙醇体积分数的增加,增大对胭脂李多酚的溶解度,从而解吸率持续上升,当乙醇体积分数达到80%时,多酚解吸率达到最大值,100%乙醇的多酚解吸率反而下降。因此选用体积分数80%的乙醇洗脱剂。
|
图 5 乙醇体积分数对解吸效果的影响 Fig. 5 Effect of ethanol concentration on polyphenol-desorption of resin |
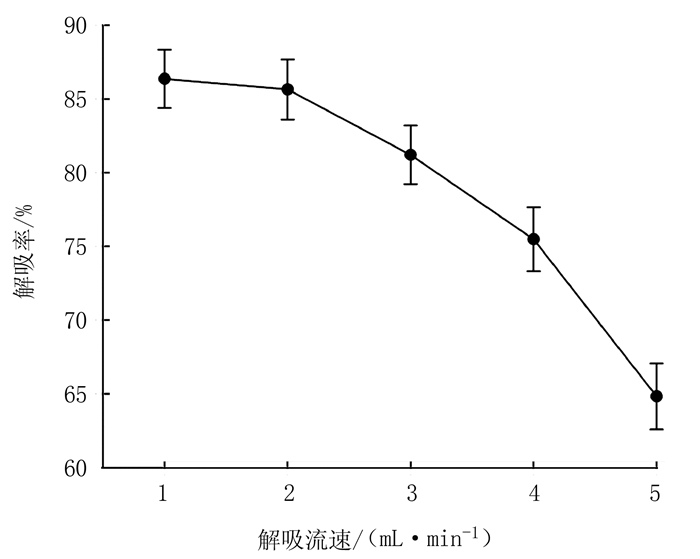
洗脱液的流速影响大孔树脂吸附分离效果,从图 6可以看出,洗脱液流速小于2 mL·min-1,胭脂李多酚解吸率大于85%,随洗脱液流速增加,解吸率呈下降趋势。这可能是由于洗脱液流速过快,洗脱剂与多酚未得到充分接触,洗脱不完全;但流速过低会增加纯化生产周期和生产成本,因此选择解吸流速为2 mL·min-1。
|
图 6 解吸流速对解吸效果的影响 Fig. 6 Effect of ethanol elution rate on polyphenol desorption of resin |
按照上述最佳工艺参数纯化胭脂李多酚,即上样浓度1.0 mg·mL-1、上样速度2.0 mL·min-1、80%乙醇溶液作为洗脱剂,洗脱流速2.0 mL·min-1,胭脂李多酚经HP-20大孔树脂纯化后,吸附率可达87.36%,解吸率可达86.78%,纯度由25.47%提高至74.89%,纯化前后胭脂李多酚纯度提高了2.94倍;说明HP-20树脂适用于胭脂李多酚物质的分离纯化。
2.4 胭脂李多酚对黄嘌呤氧化酶抑制活性 2.4.1 黄嘌呤氧化酶活性抑制测定方法研究及验证黄嘌呤氧化酶(xanthine oxidase,XO)在人体内可把黄嘌呤催化生成尿酸[19]。以磷酸缓冲盐溶液代替黄嘌呤氧化酶溶液作为空白对照,与添加黄嘌呤氧化酶溶液的反应进行比较,分析HPLC图谱(图 7),曲线B为未添加酶液,液相图谱中没有出现与尿酸色谱峰保留时间相同的色谱峰,方法具有专属性,且尿酸出峰时间与黄嘌呤出峰时间间隔分开明显,二者色谱峰不存在相互影响。取同一胭脂李多酚提取物5份,分别配制成相同溶液,依照方法反应检测,分别计算抑制率,结果表明用该法测定胭脂李多酚提取物对XO活性的抑制作用,尿酸生成的保留时间和峰面积的相对标准偏差(RSD)分别为0.73%和1.86%,具有良好的稳定性和精密度。

|
图 7 黄嘌呤氧化酶抑制活性检测HPLC色谱 注:A为添加黄嘌呤氧化酶;B为未添加黄嘌呤氧化酶。 Fig. 7 HPLC chromatogram of inhibition activity onxanthine oxidase |
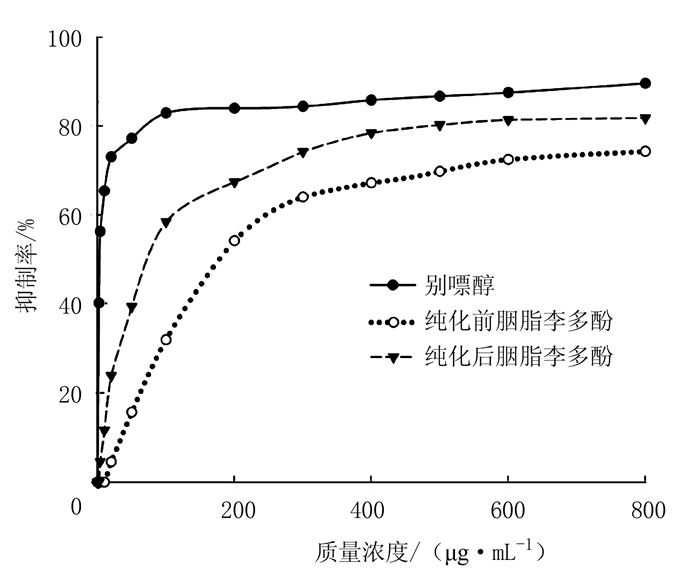
由图 8可知,胭脂李多酚对黄嘌呤氧化酶抑制活性随质量浓度增大而升高,但低于阳性对照——降尿酸常规药物别嘌醇。胭脂李多酚经HP-20大孔树脂纯化后,黄嘌呤氧化酶抑制IC50(50%抑制率的浓度)从179.21 μg·mL-1降到72.35 μg·mL-1,黄嘌呤氧化酶抑制活性提高了2.47倍。尽管胭脂李多酚对黄嘌呤氧化酶抑制活性低于别嘌醇,但胭脂李多酚天然、毒副作用小,可作为辅助降尿酸功能营养食品和药品新的原料来源。
|
图 8 纯化前后胭脂李多酚黄嘌呤氧化酶抑制活性比较 Fig. 8 Inhibitory efficacy of polyphenol onxanthine oxidase before and after purification |
通过比较4种型号大孔树脂(D101、HP-20、AB-8、DA-201)的静态吸附和解吸效果,胭脂李多酚类物质分离纯化的最佳树脂为HP-20大孔树脂,其静态吸附6h 基本达到吸附饱和,静态解吸2h后基本达到平衡。
通过动态吸附和解吸试验,得到HP-20型树脂分离纯化胭脂李多酚类物质的最佳工艺条件:上样质量浓度1.0 mg·mL-1,上样速度 2.0 mL·min-1,80%乙醇溶液作为洗脱剂,洗脱流速2.0 mL·min-1。纯化后胭脂李多酚纯度由25.47%提高至74.89%,黄嘌呤氧化酶抑制活性IC50从179.21 μg·mL-1降到72.35 μg·mL-1,黄嘌呤氧化酶抑制活性提高了2.47倍。
胭脂李作为南方重要的水果品种之一,多酚类物质含量高,本试验表明胭脂李多酚提取物具有抑制黄嘌呤氧化酶活性,可作为降尿酸功能食品或药品的天然来源,这对于提高胭脂李产品附加值、促进胭脂李果产业发展具有现实意义。然而对于胭脂李多酚产品的开发,还需要进一步开展其贮藏稳定性、动物在体试验功效等方面研究。
| [1] | 覃曦静. 武宣县胭脂李生产现状及发展策略[J]. 广西热带农业, 2009,(2):55-56.( 1) 1) |
| [2] | 林仁光. 做大做强永泰李果产业推进县域经济跨越发展[J]. 农业工程技术:农产品加工业, 2012,(1):4.( 1) 1) |
| [3] | 徐宇宇, 刘慧, 李婕,等. 李子的养生价值浅谈[J]. 安徽农业科学, 2013, 41(10):4318-4319.( 1) 1) |
| [4] | 颜孙安, 钱爱萍, 姚清华,等. 闽产李果实氨基酸组成及其营养分析[J]. 热带亚热带植物学报, 2012, 20(6):571-577.( 2) 2) |
| [5] | FU L, XU B T,XU X R,et al. Antioxidant capacities and total phenolic contents of 62 fruits, Food Chem,2011,(129):345-350.( 1) 1) |
| [6] | ARTS I C W, HOLLMAN P C H. Polyphenols and disease risk in epidemiologic studies[J]. American Journal of Clinical Nutrition, 2005, 81(1):317S-325S.( 1) 1) |
| [7] | 罗文华. 一年龄胭脂李结果技术[J]. 农家之友, 2001,(10):7.( 1) 1) |
| [8] | 周丹蓉, 叶新福, 方智振,等. 李果实色泽与花色素苷、类黄酮和类胡萝卜素含量的关系研究[J]. 福建农业学报, 2015,30(1):33-37.( 1) 1) |
| [9] | 于丽丽, 陈丹, 刘永静,等. 芙蓉李及其他李中有机酸的含量测定[J]. 福建中医药大学学报, 2009, 19(3):14-16.( 1) 1) |
| [10] | 周丹蓉, 叶新福, 潘少霖,等. 李果实花色素苷提取工艺研究[J]. 东南园艺, 2014,(6):6-10.( 1) 1) |
| [11] | 张珞. 鼠尾藻和羽藻提取物对黄嘌呤氧化酶抑制作用的研究[D]. 青岛:中国海洋大学,2013:16-23.( 2) 2) |
| [12] | 王亚杰, 张国文. 桑色素对黄嘌呤氧化酶活性的抑制作用[J]. 食品科学, 2014, 35(13):143-146.( 2) 2) |
| [13] | 刘又豪, 赵力超, 卢嘉欣,等. 桉叶提取物抑制黄嘌呤氧化酶活性成分的分离纯化及其动力学研究[J]. 广东农业科学, 2014,(14):100-105.( 1) 1) |
| [14] | 史珅, 常伟, 尚小玉,等. 几种天然产物对黄嘌呤氧化酶的抑制作用[J]. 中国食品学报, 2014, 14(7):138-143.( 1) 1) |
| [15] | ĆUJIĆ N,ŠAVIKIN K, JANKOVIĆ T, et al. Optimization of polyphenols extraction from dried chokeberry using maceration as traditional technique[J]. Food Chemistry, 2016, 194:135-142.( 1) 1) |
| [16] | 赵谋明,徐巨才,刘洋,等.秋刀鱼制备黄嘌呤氧化酶抑制肽的工艺优化[J].农业工程学报,2015,31(14):291-297.( 1) 1) |
| [17] | 苏东晓, 张瑞芬, 张名位,等. 荔枝果肉酚类物质大孔树脂分离纯化工艺优化[J]. 中国农业科学, 2014,(14):2897-2906.( 1) 1) |
| [18] | 陶莎, 黄英, 康玉凡,等. 大孔吸附树脂分离纯化红小豆多酚工艺及效果[J]. 农业工程学报, 2013,(23):276-285.( 1) 1) |
| [19] | 焉翠蔚, 常宝, 李晶,等. 孔石莼水相提取物对黄嘌呤氧化酶活性的抑制作用研究[J]. 中国海洋大学学报:自然科学版, 2015(01):30-34.( 1) 1) |
 2016, Vol. 31
2016, Vol. 31
