2. 贵州大学发酵工程 与生物制药省级重点实验室, 贵州 贵阳 550025
2. Key Laboratory of Fermentation Engineering and Biological Pharmaceutical, Guizhou University, Guiyang, Guizhou 550025, China
中国是农业大国,也是秸秆资源最丰富的国家之一[1]。据报道我国平均年产秸秆量达到6亿~7亿t,占世界秸秆总产量的20%~30%,是生物质能源十分重要的组成部分[2, 3, 4, 5]。其中,年产玉米秸秆量可达2.2 亿t[6]。玉米秸秆中含有大量高分子难分解的纤维素、木质素、半纤维素等物质[7],目前,玉米秸秆中有一小部分被用作饲料,大部分都被烧毁或弃置农田,这不但对资源造成了极度的浪费,而且也对环境造成了严重的污染[8, 9]。近年来,秸秆的合理利用不得不引起了人们的广泛关注,已成为保持农业可持续发展的及其重要的组成部分[10, 11]。
由于秸秆化学结构复杂,具有很强的抗分解能力。而单一的微生物不能产生所有分解其高分子物质的酶,因此一种微生物对其高分子物质的分解能力是有限的,对秸秆进行降解需要多种微生物的协同作用[12, 13, 14, 15]。目前,在微生物腐熟菌剂的研究方面,越来越多的学者将获得的一些纯培养菌株进行优化组,然后制成微生物复合菌剂使用,取得了良好的降解效果[16, 17]。
白腐真菌是一种对木质素有很强降解能力的菌株,但是对于纤维素的降解效果却不是很理想[18, 19],菌株S-3是从玉米秸秆上筛选出的1株能有效降解纤维素的菌株。本研究以农业废弃物玉米秸秆为基质,探讨白腐菌和菌株S-3的最佳复合降解条件,使农作物秸秆得到最大程度的降解,有效地利用和转化秸秆资源,扩大发酵产品工业原料来源,降低发酵产物成本。
1 材料与方法 1.1 试验材料 1.1.1 试验菌种及材料S-3菌株(mL):筛选自玉米秸秆; 白腐真菌(g) :购于中国工业微生物菌种保藏中心;玉米秸秆:采自贵阳市郊农田,烘干、粉碎,过40目筛; 酱油渣:贵阳市味莼园食品有限公司提供。烘干,过40目筛。
1.1.2 试验试剂琼脂、七水硫酸镁、磷酸氢二钾、维生素B1 、无水磷酸氢二钠、硼酸钠、十二烷基硫酸钠、乙二醇乙醚、乙二胺四乙酸二钠,均为分析纯试剂; 基础培养液(L):KH2PO4,2.0 g;MgSO4·7H2O,5.0 g;CaCl2·2H2O,0.094 g;VB1,100 mg;微量元素混合液,70 mL;微量元素混合液(L-1):氨基酸,0.5 g;MgSO4·7H2O,3.0 g;NaCl,11 g;FeSO4·7H2O,0.1 g;CoSO4,0.1 g;CaCl2·2H2O,0.1 g;ZnSO4·7H2O,0.19 g;CuSO4·5H2O,0.01 g;AlK(SO4)2·12H2O,0.01 g;H2BO3,0.01 g;Na2MoO4·2H2O,0.01 g; MnSO4·H2O,0.01 g。
1.1.3 试验仪器YX280B手提式灭菌锅(上海三申医疗器械有限公司);2 000 W电子万用炉(天津市泰斯特仪器有限公司);LS-1F型 净化工作台(上海索谱仪器有限公司);分析天平(上海良平仪器仪表有限公司);SPX-150C型 恒温恒湿培养箱(上海博讯实业有限公司医疗设备厂);SHZ-D(Ⅲ) 循环水式真空泵(巩义市英予华仪器厂);G3号 砂芯坩埚 (上海良平仪器仪表有限公司);碘瓶(上海良平仪器仪表有限公司);GZX-GF101-3-BS-Ⅱ烘箱(上海索普仪器有限公司);样品筛(北京三合永道)。
1.2 试验方法 1.2.1 培养基的制备(1)S-3菌株种子培养液的制备:称取200 g去皮切丁的新鲜马铃薯加入1 000 mL水加热煮沸,持续20 min,后用4层纱布过滤2~3次,加水补足至1 000 mL,加入20 g葡萄糖,3 g KH2PO4,1.5 g MgSO4·7H2O,微量维生素B1,搅拌溶解,冷却。分别分装在250 mL三角瓶中,灭菌(121℃,30 min),冷却。接种,30℃,恒温恒湿培养3 d,即为S-3菌株种子培养液; (2)发酵培养基的制备:5 g玉米秸秆粉和5 g酱油渣于250 mL的三角瓶中,加一定量的水,搅拌均匀,灭菌冷却后,接入一定量的S-3菌种子液,在一定的温度下培养,测定纤维素和木质素含量; (3)白腐真菌种子培养液的制备:称取200 g去皮切丁的新鲜马铃薯加入1 000 mL水加热煮沸,持续20 min,后用4层纱布过滤2~3次,加水补足至1 000 mL,加入20 g葡萄糖,15 g琼脂,3 g KH2PO4,1.5 g MgSO4·7H2O,微量维生素B1,搅拌溶解,冷却。分别分装在250 mL三角瓶中,灭菌(121℃,30 min),倒平板,冷却。接种白腐菌,30℃,恒温恒湿培养3 d,即为白腐菌种子培养液; (4)发酵培养基的制备:玉米秸秆5 g,酱油渣4 g,吐温50 mg,加入一定量的基础培养液,搅拌混匀。
1.2.2 测定方法中性洗涤纤维测定:准确称取1 g样品置于100 mL 碘瓶中,加入70 mL中性洗涤剂,之后放入已沸的高压锅,100℃保温40 min,115~121℃保温20 min,煮沸完毕后,取下碘瓶,将溶液倒入安装在抽滤瓶上的已知重量的玻璃坩埚中进行过滤,将碘瓶中的残渣全部移入,并用沸水冲洗玻璃坩埚与残渣,直洗至滤液呈中性为止,依次用95%乙醇、无水乙醇和丙酮洗涤2次,抽滤,将残渣置真空干燥器中,干燥20 min,称至恒重。
酸性洗涤纤维测定:准确称取1 g样品置于碘瓶中,加入70 mL酸性洗涤剂,之后放入已沸的高压锅,100℃保温50 min,煮沸完毕后,趁热用已知重量的玻璃坩埚抽滤,并用沸水反复冲洗玻璃坩埚及残渣至滤液呈中性为止。用少量丙酮冲洗残渣至抽下的丙酮液呈无色为止,并抽净丙酮。将玻璃坩埚置于80℃烘箱中烘2 h后,在干燥器中冷却30 min称重,直称至恒重。
酸性洗涤木质素和酸不溶灰分测定:将酸性洗涤纤维加入72%硫酸,在20℃消化3 h后过滤,并冲洗至中性。消化过程中溶解部分为纤维素,不溶解的残渣为酸性洗涤木质素和酸不溶灰分,将残渣烘干并灼烧灰化后即可得出酸性洗涤木质素和酸不溶灰分的含量。
中性洗涤纤维含量的计算:
NDF/%=[(W1-W2)/ W]×100%
式中:W1为玻璃坩埚和NDF重(g); W2为玻璃坩埚重(g);W为试样重(g)。
酸性洗涤纤维含量的计算:
ADF/%=[(G1-G2)/G]×100%
式中:G1为玻璃坩埚和ADF重(g);G2为玻璃坩埚重(g);W为试样重(g)
纤维素含量的计算:
纤维素/%=ADF-经72%硫酸处理后的残渣
木质素含量的计算:
ADL/%=残渣-灰分
降解率/%=[(降解后含量-初始含量)/初始含量]×100%
1.2.3 单因素试验(1)不同S-3菌株与白腐真菌复合配方对玉米秸秆降解效果: 玉米秸秆5 g,酱油渣4 g,Tween 80用量为50 mg,料水比1∶2.5,搅拌混匀后,分别接入如表 1所示的S-3菌株与白腐真菌的用量,在30℃条件下培养,发酵14 d后测定发酵培养基中的木质素和纤维素的含量; (2)不同发酵时间对玉米秸秆降解效果: 玉米秸秆5 g,酱油渣4 g,Tween 80用量为50 mg,料水比1∶2.5,搅拌混匀后,S-3菌株与白腐真菌的复合配方为8∶8,在30℃条件下培养,分别发酵5、8、11、14、17、21 d后测定发酵培养基中的木质素和纤维素的含量; (3)不同发酵温度对玉米秸秆降解效果: 玉米秸秆5 g,酱油渣4 g,Tween 80用量为50 mg,料水比1∶2.5,搅拌混匀后,S-3菌株与白腐真菌的复合配方为8∶8,分别在26、28、30、32、34、36℃条件下培养,发酵14 d后测定发酵培养基中的木质素和纤维素的含量; (4)不同料水比对玉米秸秆降解效果: 玉米秸秆5 g,酱油渣4 g,Tween 80用量为50 mg,料水比分别为1∶1、1∶1.5、1∶2、1∶2.5、1∶3、1∶3.5,搅拌混匀后,S-3菌株与白腐真菌的复合配方为8∶8,在31℃条件下培养,发酵14 d后测定发酵培养基中的木质素和纤维素的含量。
| 表 1 S-3菌株与白腐真菌用量 Table 1 Dosage of S-3/white rot fungi mixture for fermentation |
在单因素实验的基础上,以S-3菌株与白腐真菌的复合配方、发酵时间、发酵温度和料水比4个因素,选择L9(34)进行正交试验设计,设计水平与因素见表 2。
| 表 2 正交试验因素水平 Table 2 Factors and levels of orthogonal experiment |
采用 Excel 和 SPSS 22.0对数据进行统计分析,采用Duncan法进行多重比较。
2 结果与分析 2.1 复合菌剂降解玉米秸秆的单因素试验结果 2.1.1 不同S-3菌株与白腐真菌复合配方对玉米秸秆降解效果由图 1可知,随着复合菌剂中S-3菌株比例增加,复合菌剂降解纤维素的能力不断增强,同时,纤维素占发酵干基的比率也在不断下降。当S-3菌株和白腐菌的用量从2 mL和14 g变化到10 mL和6 g时,纤维素下降的速率非常迅速;当S-3菌株和白腐菌的用量从10 mL和6 g变化到12 mL和4 g时,纤维素下降的速率趋于缓慢。因此,复合菌剂的配方是S-3菌株∶白腐菌=10∶6,此时纤维占发酵干基的比率由最初的35.48%降到23.32%,降解率为34.27%。
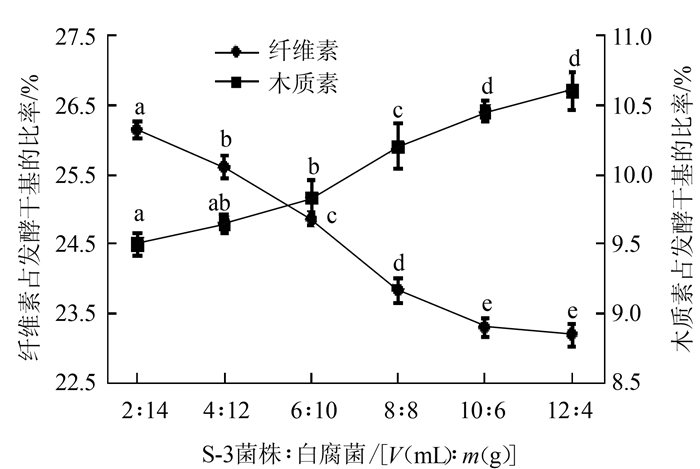
|
图 1 不同白腐真菌与S-3菌株复合配方对降解玉米秸秆效果 注:不同小写字母表示差异显著,图2~4同。 Fig. 1 Effect of combination ratio of white rot fungi and S-3 on degradation of cornstalks |
随着复合菌剂中白腐菌用量的增加,复合菌剂降解木质素的能力也在不断增强。从整个曲线的变化趋势看,选择S-3菌株∶白腐菌=6∶10为降解木质素的最佳菌剂配比,此时木质素占发酵干基的比率由最初的15.37%降到9.73%,降解率为36.69%。
综合纤维素和木质素的最佳降解菌剂配比,选择S-3菌株与白腐菌用量配方为8 mL∶8 g,此时纤维素和木质素占发酵干基的比率分别为23.87%和10.04%,降解率分别为32.72%和34.68%。
2.1.2 不同发酵时间对玉米秸秆降解效果由图 2可知,随着发酵时间的延长,纤维素和木质素占发酵干基的比率不断下降。当发酵时间为21 d时,纤维素和木质素占发酵干基的比率最小,分别为22.83%和9.65%,降解率分别为35.65%和37.22%。从经济上考虑,复合菌剂的最佳降解时间选取纤维素和木质素下降速率逐渐平缓的点,即14 d为宜,此时纤维素和木质素占发酵干基的比率分别为23.22%和9.76%,降解率分别为34.55%和36.50%。
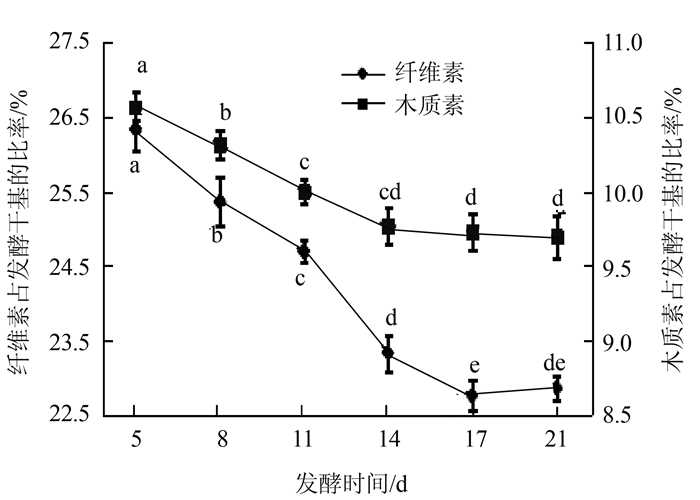
|
图 2 不同发酵时间对降解玉米秸秆效果影响 Fig. 2 Effect of fermentation duration on degradation of cornstalks |
当温度从26℃升至32℃时,纤维素占发酵干基的比率逐渐下降;当温度从32℃升至36℃时,复合菌剂降解纤维素的能力又在不断下降,因此选择32℃为复合菌剂降解纤维素的最佳发酵温度,在此条件下纤维素占发酵干基的比率从最初的35.48%降为23.14%,降解率为34.78%(图 3)。
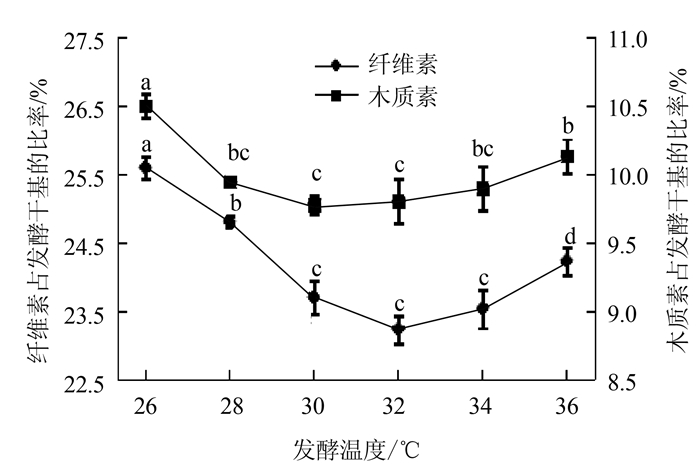
|
图 3 不同发酵温度对降解玉米秸秆效果影响 Fig. 3 Effect of fermentation temperature on degradation of cornstalks |
发酵温度对复合菌剂降解木质素的能力也有一定的影响,复合菌剂降解木质素的最佳发酵温度是30℃,在此条件下木质素占发酵干基的比率由最初的15.37%降为9.72%,降解率为36.76%。综合纤维素和木质素的最佳降解温度,选择32℃为最佳的降解温度。
2.1.4 不同料水比对玉米秸秆降解效果由图 4可知,料水比由1∶1增加到1∶2.5,纤维素素和木质素占发酵干基的比率不断下降,表明复合菌剂降解玉米秸秆的能力在不断的增强;当料水比由1∶2.5增加到1∶3.5时,复合菌剂降解秸秆的能力又有所下降,这可能与培养基中的O2含量多少有关。因此选择1∶2.5为降解玉米秸秆的最佳料水比,在此条件下纤维素和木质素占发酵干基的比率分别为23.31%和9.68%,降解率分别为34.30%和37.02%。
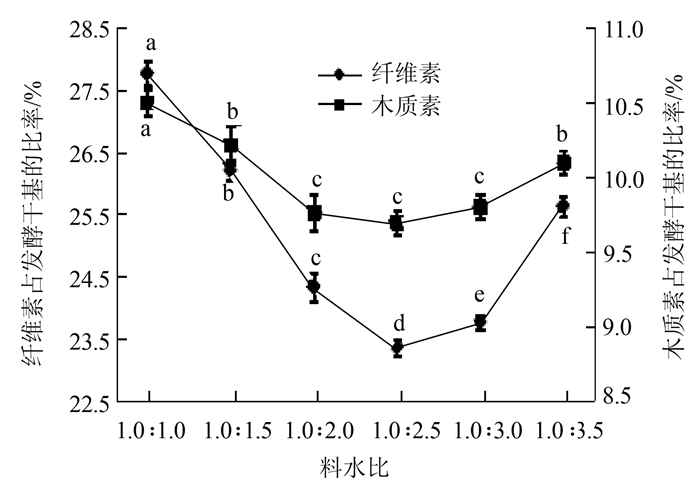
|
图 4 不同料水比对降解玉米秸秆效果影响 Fig. 4 Effect of ratio of cornstalks to water on degradation of cornstalks |
由表 3中纤维素的R值可知,S-3菌株与白腐真菌复合配方对复合菌剂降解纤维素的影响最大,其次是发酵时间。由正交试验得出复合菌剂降解纤维素的最佳的实验组合是:A2B3C1D2,即S-3菌株∶白腐真菌=8∶8,发酵时间为17 d,发酵温度为30℃,料水比为1∶2.5,在此条件下纤维素占发酵干基的比率由最初的35.48%降为22.85%,降解率为35.60%。由表 4对纤维素的方差分析可知,S-3菌株与白腐真菌复合配方和发酵时间对复合菌剂降解纤维素的影响达到显著水平。
| 表 3 正交试验结果分析 Table 3 Results of orthogonal test |
| 表 4 正交试验方差分析 Table 4 Variance analysis for orthogonal test results |
由表 3中木质素的R值可知,发酵时间对复合菌剂降解木质素的影响最大,其次是发酵温度,最佳降解木质素的实验方案为A2B3C1D2, 即S-3菌株与白腐真菌复合配方为8∶8,发酵时间为17 d,发酵温度为30℃,料水比为1∶2.5,在此条件下木质素占发酵干基的比率由最初的15.37%降为9.62%,降解率为37.41%。由表 4中对木质素的方差分析可知,发酵时间对复合菌剂降解木质素的影响达到显著水平。
3 讨论与结论秸秆主要是由纤维素、半纤维素和木质素等成分组成,其化学结构非常复杂,并且具有很强的抗分解能力。而单一的微生物不能产生所有分解纤维素的酶,因此一种微生物对其高分子物质的分解能力是有限的,对秸秆进行分解需要多种微生物的协同作用。因此,混合菌的作用越来越受到重视[20, 21, 22]。大量研究表明,各菌种对环境的要求苛刻以及菌种间产生相互依赖、相互协同的作用等原因,使大部分微生物无法通过实验室分离培养方法获得,得到的只是极小部分微生物,很不全面,分泌的酶系较单一,并且使用效果有限[23]。因此在微生物腐熟菌剂的研究方面,越来越多的学者将获得的一些纯培养菌株进行优化组合,然后制成微生物复合菌剂使用,取得了良好的堆肥腐解效果。笔者进行复合菌剂对玉米秸秆生物降解作用的研究,为复合菌剂的进一步发展提供了依据,并开发出能用于农业生产的微生物复合菌剂,最终解决了由于秸秆焚烧和废弃等产生的环境危害问题。
目前,国内外对于秸秆高效腐熟菌剂的研究己有较大进展。邱向阳、黄得扬等[24, 25]对在秸秆堆肥体系中筛选出的高效纤维素降解菌群进行了研究,并构建了用于花卉秸秆高效堆肥的复合降解微生物菌剂;王伟东等[26]以麦秸垛下的土壤和麦秸堆肥为材料,利用限制性培养技术,经过多代淘汰及其不同系之间的组配,最终筛选构建了一组木质纤维素分解菌复合系;Haruta等[27]筛选的高效稳定的纤维素分解菌群,这些菌株组合的纤维素分解能力明显优于单株菌。笔者进行了复合菌剂对玉米秸秆生物降解作用的研究,为复合菌剂剂的进一步发展提供依据,并开发出能用于农业生产的微生物复合菌剂,最终解决由于稻秆焚烧和废弃等产生的危害。
本研究只选取了玉米秸秆作为被降解的对象,酱油渣为辅料。在今后的研究中,还可以选取其他的农作物秸秆作为发酵底物或其他企业下脚料如,酒糟、醋糟、药渣等作为发酵的辅料,进行深入研究。做到实现利用农作物秸秆的最大程度化,减少资源的浪费;本研究中从玉米秸秆中分离筛选出的S-3菌株,对农作物秸秆的降解具有很强的降解能力,如果能从其降解机理、代谢规律等方面做更加深层次的研究,通过基因突变选育出优良的S-3菌株变种,S-3菌株将会发挥其更大降解纤维素的能力。
本试验研制出由S-3菌株和白腐真菌复合而成的复合菌剂,能够有效地降解玉米秸秆中的纤维素和木质素,充分利用两种菌株的降解优势,达到同时降解玉米秸秆的目的;由单因素和正交试验得出降解玉米秸秆的最佳条件为:S-3菌株与白腐真菌的复合配方为8∶8,发酵时间为17 d,发酵温度为30℃,料水比为1∶2.5,在此条件下,秸秆纤维素的降解率为:35.60%,木质素的降解率为:37.41%。
| [1] | 梁军锋,张洪生,张克强,等. 木质素降解菌的筛选及对秸秆的降解研究[J]. 华北农学报,2009,(5):206-209.( 1) 1) |
| [2] | 中国人民共和国统计局.2005年国家统计年鉴[M].北京:中国统计出版社,2006.( 1) 1) |
| [3] | 贾昕宇,王宏立,张吉军.农作物秸秆资源的开发与利用[J].农机化研究,2007,(7):217-219.( 1) 1) |
| [4] | 汪海波,章瑞春.中国农作物秸秆资源分布特点与开发策略[J].山东省农业管理干部学院学报,2007,23(2):164-165.( 1) 1) |
| [5] | 周沅洁,马桂英,王修俊,等. 一株降解玉米秸秆菌株的分离、鉴定及其降解能力的研究[J]. 广东农业科学,2012,(20):87-90.( 1) 1) |
| [6] | 梁英,梁凌云,徐凤英,等.玉米秸秆液化工艺研究[J].安徽农业科学,2009,37(27):13428-13429.( 1) 1) |
| [7] | 杨兴,张起凯,李萍.玉米秸秆预处理技术及资源化研究进展[J].辽宁农业科学,2009,(6):35-37.( 1) 1) |
| [8] | 李春光,王彦秋,李宁,等. 玉米秸秆纤维素提取及半纤维素与木质素脱除工艺探讨[J]. 中国农学通报,2011,(1):199-202.( 1) 1) |
| [9] | 马桂英,王修俊,曲源,等.农作物秸秆资源的基本现状及其研究[J].科技成果管理与研究,2011,61(11):59-60.( 1) 1) |
| [10] | 张文斌,张龙全.秸秆气化技术研究现状与对策分析[J].中国农机化,2009,(6):90-93.( 1) 1) |
| [11] | 曲源,王修俊,孙倩.发酵和酶解共处理玉米秸秆研究[J].安徽农业科学,2010,38(19):10484-10485.( 1) 1) |
| [12] | 王元明. 高温纤维素降解菌的筛选及其复合菌剂对秸秆降解效果的研究[D].南京:南京农业大学,2013.( 1) 1) |
| [13] | MOSIER N, WYMAN C, DALE B, et al.Features of promising technologies for pretreatment of lignocellulosic biomass[J].Bioresource Technology,2005, 96:673-86.( 1) 1) |
| [14] | SUN Y, CHENG J. Hydrolysis of lignocellulosic materials for ethanol production:a review[J].Bioresource Technology,2002, 83:1-11.( 1) 1) |
| [15] | 王修俊,邓婉婷,刘颖.有效微生物群发酵玉米秸秆的工艺条件研究[J].中国酿造,2008,(11):47-49.( 1) 1) |
| [16] | 崔宗均,李美丹,朴哲,等.一组高效稳定纤维素分解菌复合系MC1的筛选及功能[J].环境科学,2002,23(3):36-39.( 1) 1) |
| [17] | 刘婷,陈朱蓄,周敬宜.外源接种粪便好氧堆肥的微生物相变化研究[J].华中科技大学学报:城市科学版,2002,19(2):57-59.( 1) 1) |
| [18] | 李慧容.白腐真菌生物学和生物技术[M].北京:化学工业出版社,2005.( 1) 1) |
| [19] | LAL R.World crop residues production and implications of its use as a biofuel[J].Environment International, 2005,31:575-584.( 1) 1) |
| [20] | 史玉英,沈其荣,娄无忌,等.纤维素分解菌群的分离和筛选[J].南京农业大学学报,1996,19(3):51-57.( 1) 1) |
| [21] | 杨盛,侯红萍.高效降解纤维素混合茵的筛选及其产酶条件的研究[J].中国印染,2008,(21):20-23.( 1) 1) |
| [22] | 宋颖琦,刘睿倩,杨谦,等.纤维素降解菌的筛选及其降解特性的研究[J].哈尔滨工业大学学报,2002,34(2):197-200.( 1) 1) |
| [23] | 马放,杨基先,金文标,等.环境微生物制剂的开发与应用[M].北京:化学工业出版社,2004.( 1) 1) |
| [24] | 邱向阳,陆文静,王洪涛,等.蔬菜-花卉秸秆混合联合堆肥性状表征及纤维素分解菌群选育研究[J].北京大学学报:自然科学版,2003,39(2):254-261.( 1) 1) |
| [25] | 黄得扬,陆文静,王洪涛,等.高效纤维素分解菌在蔬菜-花卉秸秆联合好氧堆肥中的应用[J].环境科学,2004,25(2):145-149.( 1) 1) |
| [26] | 王伟东,崔宗均,牛俊玲,等.一组木质纤维素分解菌复合系的筛选及培养条件对分解活性的影响[J].中国农业大学学报,2004,9(5):7-11.( 1) 1) |
| [27] | HARUTA S,CUI Z,HUANG Z,et al.Construction of a stable microbial community with high cellulose-degradation ability[J].APPI Microbiol Biotechnol,2002,59:529-534.( 1) 1) |
 2016, Vol. 31
2016, Vol. 31
