2. 福建省农业科学院水稻研究所, 福建 福州 350019;
3. 农业部华南杂交水稻种质创新与分子育种重点实验室/福州(国家)水稻改良分中心/福建省作物分子育种工程实验室/福建省水稻分子育种重点实验室/福建省作物种质创新 与分子育种省部共建国家重点实验室培育基地/杂交水稻重点实验室华南研究基地/水稻国家工程实验室, 福建 福州 350003
2. Rice Research Institute, Fujian Academy of Agricultural Sciences, Fuzhou, Fujian 350019, China;
3. Key Laboratory of Germplasm Innovation and Molecular Breeding of Hybrid Rice for South China, Ministry of Agriculture/Fuzhou branch, National Rice Improvement Center of China/Fujian Engineering Laboratory of Crop Molecular Breeding/Incubator of National key Laboratory of Crops Germplasm Innovation and Molecular Breeding Between Fujian and Ministry of Science and Technology/South China Base of National Key Laboratory of Hybrid rice for China/National Engineering Laboratory of Rice of China, Fuzhou, Fujian 350019, China
水稻是主要粮食作物之一,全球超过50%以上的人口以水稻为主食 [1]。稻瘟病是水稻生产中发生最主要,也是最严重的病害之一,又有水稻“癌症”之称,在世界水稻各种植区均有发生,发病严重且易反复发生,很难得到彻底控制。稻瘟病菌Magnoporthe grisea是第一个基因组测序完成的植物病原菌,是研究真菌性病害与宿主之间相互作用的一种模式真菌,稻瘟病菌的基因组大约40 Mb,包含7对染色体[2]。
1 稻瘟病菌致病机理稻瘟病菌属于子囊菌纲,在无性生殖阶段称为Pyricularia grisea(Cooke)Sacc,发病阶段称为Magnaporthe grisea(Hebert) Barr。稻瘟病菌以无性阶段完成生活史,主要以分生孢子和菌丝为侵染源,感染水稻叶片使其发生症状,具体过程如下:分生孢子的产生、萌发管产生芽管、附着胞的形成、侵染栓分化以及次生菌丝的生长与感染(图 1)。在外界环境适宜的条件下,稻瘟病菌产生大量的分生孢子,通过空气传播到水稻地上部分,开始侵染,当分生孢子接触水稻叶片时,受到外部的刺激(如硬度、疏水性),释放尖端粘液紧紧附着叶片表面,接着孢子萌发管产生芽管,芽管顶端能够产生粘胶物质,使芽管紧紧附着在叶片表面;进一步芽管停止生长,顶端卷曲形成钩状体,并膨大开始形成附着胞,附着胞是稻瘟病菌产生的一种特殊的侵染结构,但附着胞必须经过黑色素化才具有侵染能力;随着附着胞的成熟,大量黑色素沉积在细胞壁内,形成黑色素层,黑色素层有利于细胞内渗透物质的积累和膨压的产生,根据测量结果表明附着胞膨压高达8 MPa[2],产生的膨压使侵染栓穿透水稻叶片角质层和表皮细胞壁 [3],这一穿透作用主要是机械作用力,同时酶或其他辅助因子也参与该过程;接着侵染栓分化成侵染菌丝,侵染相邻的表皮细胞,并深入叶肉细胞,一般侵染后5~7 d出现症状,被侵染的细胞可进一步产生菌丝和分生孢子,传染给新的水稻植株。此外,稻瘟病菌不仅感染水稻,还能够感染其他重要经济作物,如大麦、燕麦、黑麦草、小米等。
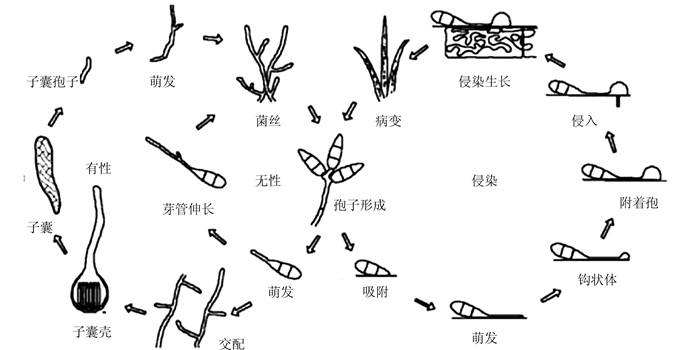
|
图 1 稻瘟病菌的生活史 Fig. 1 Life cycle of Magnaporthe grisea |
众所周知,抗稻瘟病品种的利用是目前保护水稻不受稻瘟病害危害的最有效方式之一。但是,种植抗稻瘟病品种并不能持久的控制稻瘟病的发生,因为外界环境发生变化,导致病原菌的变异或新的稻瘟病菌的产生,使水稻体内抗病基因无法抵抗该病菌,于是抗病品种所携带的抗性在数年内逐渐被破坏或者丧失。稻瘟病菌的致病基因和寄主的抗病基因之间的相互关系可以用“基因对基因假说”来解释[4],稻瘟病菌有能力克服水稻的小种专化抗性基因。因此,三者(稻瘟病菌、外界环境条件和水稻品种)的相互作用可能对水稻品种的抗病性造成影响。
2.1 病菌致病性变异稻瘟病菌的生理小种组成复杂,群体大,繁殖快,再加上突变、异核现象,准性生殖、菌丝融合等因素,因此自然界中稻瘟病菌致病性的变异始终存在[5]。稻瘟病菌在有性生殖阶段,通过交配和重组形成新的物种[6]。如果毒性基因存在不同的菌株内,通过杂交获得新的菌株,该菌株含有2个毒性基因,那么这个新的菌株可以使2个与之对应的抗性基因品种丧失抗性。迄今为止,稻瘟病菌的有性态在自然界尚未发现,认为它不是稻瘟病菌变异的主要途径。准性生殖被认为是稻瘟病菌致病性变异的主要原因之一。准性生殖涉及3个部分:菌丝融合形成异合体;核配(异核细胞内的2个细胞核融合,形成杂合二倍体细胞核);体细胞重组产生重组体[7]。Yamasaki和Niizeki观察联结现象中的核行为,并通过配对并2个不同的营养缺陷型菌株获得变种,首次证明准性生殖可能导致稻瘟病菌致病性发生变异[8]。Genovesi和Magill通过配对不同的营养缺陷型亲本菌系产生营养缺陷型重组体[9]。Fatemi和Nelson也通过配对不同的菌株获得到重组体[10],然而准性生殖导致Magnoporthe grisea致病性变异在遗传学角度上并未得到证实。突变是导致病原菌变异的另一个主要途径,是稻瘟病菌遗传重组的基础[11, 12]。清泽等认为稻瘟病菌的1 个菌系由非致病性向致病性突变,是新小种产生的主要原因[3]。
2.2 环境的影响外界环境是有利于稻瘟病发生的生态条件,也是稻瘟病病害发生和流行的重要诱因 [14]。温度与稻瘟病发生的关系主要涉及以下几个方面:第一,稻瘟病菌的活动,一些学者报道菌丝发育的温度以26~28℃最为适宜,分生孢子的形成在25~28℃最适宜。第二,温度同样影响着水稻的生长,夏季温度若是过低则导致水稻生长不良,使其抗病能力减弱,增强其发病的可能性。第三,土壤温度低有利于病害的发生。在温度适宜发生病害的范围内,空气湿度就成了稻瘟病发生的决定因素。孢子萌芽与湿度密切相关,高湿度促进孢子的萌芽,而且高湿度持续的时间越久越利于病害的发生和流行。因此在高温多雨时应注意病害的发生,提前做好准备工作。光照也影响稻瘟病害的发生。日光有杀伤病菌或抑制病原菌活动的能力,光照不足也加重病害的发生。此外,环境条件也影响着抗性基因的表达。Wang 等[15, 16]Pib家族基因的表达会在有利病菌侵染的环境条件的影响而上调表达。
2.3 寄主的作用稻瘟病菌的变异和环境条件的变化不是人类可以左右的,但是我们可以选择种植的水稻品种。一般籼稻比粳稻抗病,耐肥的品种比不耐肥的品种抗病。种植抗病品种的面积也影响病害的发生。若同一区域种植同一主效抗病基因品种,稻瘟病害发生的风险性越大,则抗性减弱或丢失的可能性就越大。
3 稻瘟病菌无毒基因的克隆无毒基因与其寄主体内的抗性基因符合“基因对基因假说”。尽管许多研究已经表明稻瘟病的R基因是极为多样化,并且在其宿主种群迅速发展,但无毒基因在病原菌的进化模式知之甚少。到目前为止,水稻中已确定了84个抗性基因,但稻瘟病菌的高度变异性,在数年内就能克服抗性栽培品种。基因对基因假说表明1个植物抗性基因产物可以识别1个独特的无毒蛋白[17]。大量的研究表明一些无毒蛋白能够被抗性蛋白识别。通过这种方式,无毒基因的不稳定性可能战胜水稻抗性基因,包括基因的缺失和置换,转座子的插入和点突变等[18]。将携带AvrPib等位基因的108个不同的菌株重测序发现存在4个途径[转位因子(TE)插入、部分缺失、完全缺失和点突变]导致无毒基因的功能丧失[19]。
迄今为止已克隆了12个无毒基因(表 1),分别为PWL1、PWL2 、Avr1-CO39、ACE1、Avr-Pita、Avr-Pia、Avr-Pii、Avr-Pita1、Avr-Pizt、Avr-Pi9、Avr-Pik/km/kp、AvrPib[18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28]。这些无毒基因除了ACE1外都编码分泌蛋白。ACE1编码1个假定的聚酮化合物合酶/肽合酶,没有检测到有Pi33蛋白所识别的N末端分泌钛产物[29]。幸运的是,这些分泌蛋白编码的无毒基因相对应的同源R基因已被克隆,发现R-Avr之间存在3种不同的识别模式。Pita/Avr-Pita代表第1种模式,1个R基因对应1个无毒基因[30]。以Pi-CO39/Avr1-CO39和Pia/Avr-Pia为代表的第2种:1个抗性基因能够识别2个序列不相关的无毒基因[25, 31, 32, 33]。 吴军等研究发现Avr-Pi9和Avr-Pizt也属于第2种识别模式[28]。Avr-Pizt编码小的分泌蛋白,并且与已知的蛋白没有同源性[18, 34],抗性基因Pizt 识别的Avr-Pizt能在本氏烟Nicotianabenthamiana中抑制BAX-介导的程序性细胞死亡[18]。Avr-Pi9编码小的分泌蛋白,被定位于活体营养界面复合物,在水稻感染期间被转运到寄主细胞内。Avr-Pi9和其旁系同源基因在7号染色体着丝粒区域近端形成串联基因排列[28]。Pik和Avr-Pik等位基因代表第3种识别模式,不同的抗性等位基因能够识别不同的无毒等位基因。5个不同的Avr-Pik单倍型(A-E)已经被确定,它们之间只存在1~3个不同的氨基酸差异。其中Avr-Pik-D 能够识别其他Pik等位基因(Pik*,Pikp,Pikm,Piks,Pikh),然而Avr-Pik-A对它们都不能识别[35, 36]。对于Pii/Avr-Pii,Pii被定位于Pi3/5位点,Pi5和Pi15被鉴定于不同的栽培品种。目前还不能确定Avr-Pii能否被Pi5[37]和Pi15所识别。
| 表 1 已克隆的无毒基因 Table 1 Avirulence genes cloned |
目前防止稻瘟病害的最有效方法之一是利用R基因培育持久抗稻瘟病品种。选育和推广抗病水稻品种 (组合) 是控制水稻稻瘟病病害最安全、经济和环保的方法,因为它可以减少杀菌剂在稻田的使用,减少生产成本,减少农药对稻田的污染。因此,发掘新的抗稻瘟病病基因和合理应用已成为当今抗病育种的基础。截至2015年3月,已至少报道了69个抗稻瘟病位点共84个主效基因。目前已有Pb1、 Pia/、RGA4、 Pib、 Pid2、 Pid3、 Pik、pike、Pik-h/Pi54、 Pi9、 Pik-m、 Pik-P、 Pish、 Pit、 Pita、 Piz-t、 Pi1、 Pi2、 pi21、 Pi25、 Pi36、 Pi37、Pi5、 Pi56/qBR9.1、 Pi63/Pikahei-1(t)、 PiCO39等25个基因被成功克隆(表 2);其中Pi-1(t)、 Pi2、 Pi9、 Pi20(t)、 Pi27(t)、 Pi39(t)、Pi40(t) 和Pikh被报道为广谱抗性基因、Pia、 Pib、 Pii、 Pi-km、 Pi-t、 Pi12(t) 和Pi19(t)为小种专化抗性基因,这些信息极大地推进我们控制稻瘟病生理小种专化性的分子机制的理解。
| 表 2 已克隆的稻瘟病抗性基因 Table 2 Blast-resistance gene cloned |
将具有相似背景的抗(80%~90%)感(10%~20%)品种混合种植可以减少新的稻瘟病生理小种的形成。这个策略早期被提出,但需要品种农艺性状的一致性,通过混合种植多个水稻品种形成作物种内多样性,可以有效地制约稻瘟病菌的快速变异,延长水稻抗病品种的使用年限 [60]。在我国云南省,将高感的糯米品种和非糯米杂交籼稻的混合种植,主栽品种抗性越强,对防治稻瘟病发生的效果越好[61, 62]。王平等在四川省5个地点(内江资中、泸州叙永、成都蒲江、南充营山、雅安草坝)进行品种混种试验,在雅安地区通过杂糯间栽(杂交稻、糯稻间种)可以有效控制叶瘟和茎瘟,杂糯间栽的叶瘟平均发病率比净栽糯稻下降46%~88%,颈瘟控制在11%~76% [63]。Raboin等在马达加斯加高地按照一定的比例将抗病和感病栽培品种混合种植,发现品种混种的平均发病率比净栽感病品种下降46%~56% [64]。
4.3 基因聚合抗性品种携带的抗病基因通常会被与之相对应的毒性病原菌所克服,根据基因对基因假说、加性效应,将多个抗性基因聚合到1个水稻品种中以预防水稻品种抗性的减弱或丧失是可行。因此,人们认为将抗性基因聚合是形成持久抗稻瘟病重大战略之一,因为与克服仅仅单基因控制的抗性相比,病原菌克服两个或者多个抗性基因的可能性将大大降低[65]。通过分子标记辅助选择(MAS)育种将基因聚合是遗传改良最有效、快速的方法。Perumalsamy等通过分子标记将3个水稻白叶枯病抗性基因(xa5、xa13、Xa21)聚合到籼稻感病栽培品种 “ADT43” 和 “ASD16”中,经过评估发现二者产量提高,并具有抗白叶枯病;Singh等通过标记辅助育种聚合水稻白叶枯病抗性基因(xa13 和 Xa21),稻瘟病抗性基因(Pi54)和主效QTL (qSBR11-1)于印度香米‘Improved Pusa Basmati 1’和‘Tetep’中,评估发现不仅能提高其抗病性,还改良了其口感;Pinta等运用MAS成功地将白叶枯病抗性基因和稻瘟病抗性基因聚合到栽培品种RD 6上 [66]。Gouda等运用标记辅助回交育种(MABC)把稻瘟病抗性基因(Pi-1 和Piz-5)聚合到栽培品种PRR78[67]。李锦江通过MAS技术聚合Xa4、Xa7和Pi157获得材料08F039 -7-2,鉴定发现该材料对叶瘟和穗颈瘟表现中抗;聚合Xa21和Pita获得材料08F014 -2-1,对叶瘟和穗颈瘟分别表现高抗和抗;聚合Xa7、Xa21、Pi157和Pita获得的材料A6 -20 -2 对白叶枯病表现高抗,对叶瘟和穗颈瘟表现中抗 [68]。杜太宗等通过MAS技术将稻瘟病抗性基因Pi9和Pi1聚合到金23B中进行田间自然诱发鉴定发现聚合材料对叶瘟、穗颈瘟抗性提高[69]。
5 问题与展望水稻育种者们育种过程中遇到的主要障碍是缺乏一些可以在不同地区有效抵御多种稻瘟病菌生理小种的R基因,这个问题使他们在育种过程中不知如何选用哪些R基因。虽然已经报道有大量的抗性基因被发现和克隆,遗憾的是,并不是所有的抗性基因对稻瘟病致病性菌株起作用。因此,在水稻抗性育种过程中如何运用其中一些抗性基因需要加以考虑。尽管已克隆25个R基因使我们对水稻中抗稻瘟病分子基础有了一定的了解,但是只有少数R基因可以在相当长的时间内有效地防御稻瘟病菌的各种变异和稻瘟病的发生,而且稻瘟病菌的迅速进化和变异快,所以从地方品种内挖掘新的R基因非常重要。
育种家们运用传统的育种方法培育了很多适应世界不同的稻作区的稻抗性栽培品种。由于稻瘟病菌的易变性和复杂性,水稻仍然受到稻瘟病害的威胁 [70]。同时,传统育种还存在一定的局限性,如基因表达的上位效应,基因聚合等。相反,运用MAS方法将多个抗性基因聚合培育持久抗性品种是预防稻瘟病的有效方法,基因聚合育种也是未来抗病育种的一个重大策略。聚合2个或2个以上的R基因对于水稻育种具有重要的意义,单独聚合多个抗稻瘟病基因或结合其他病害的抗性基因也能够减少因稻瘟病造成的巨大损失,培育出新的持久、广谱性抗病品种。同时转基因技术的应用也是提高植物抗性的途径之一。此外,稻瘟病遗传资源的实用性对培育抗病品种也起着重要的作用。
随着分子技术的发展以及各个学科方法的交叉应用,人们将更快地挖掘出新的广谱性、持久性R基因,为育种者提供理论基础,相信育种者们在不久的未来一定可以选择和培育出抗病、高产、优质的栽培品种。
| [1] | 张佩胜,赵春德,余宁,等.稻瘟病抗性基因的克隆及应用研究进展[J]. 中国稻米, 2014, 20(5):1-7.( 1) 1) |
| [2] | DEAN R A, TALBOT N J, EBBOLE D J, et al.The genome sequence of the rice blast fungus Magnaporthe grisea[J]. Nature, 2005, 434(7036):980-986.( 2) 2) |
| [3] | RYDER L S, TALBOT N J.Regulation of appressorium development in pathogenic fungi[J]. Current opinion in plant biology, 2015, 26:8-13.( 2) 2) |
| [4] | SILUE D, NOTTEGHEM J L, THARREAU D.Evidence of a gene-for gene relationship in the Oryza sativa-Magnaporthe grisea pathosystem[J]. Phytopathology, 1992, 82(5):577-580.( 1) 1) |
| [5] | 孙国昌,孙漱沅,申宗坦,等.中国部分抗稻瘟病水稻品种的抗病特性和菌株[J]. 浙江农业学报, 1992, 4(1):1-7.( 1) 1) |
| [6] | NEWTON M, JOHNSON T, BROWN A M.A preliminary study on the hybridization of physiologic forms of Puccinia graminis tritici[J]. Scientific Agriculture, 1930:721-731.( 1) 1) |
| [7] | TSUJIMOTO NOGUCHI M.Parasexual Recombination in Magnaporthe oryzae[J]. Japan Agricultural Research Quarterly, 2011, 45(1):39-45.( 1) 1) |
| [8] | YAMASAKI Y, NIIZEKI H.Studies on variation of the rice blast fungus Pyricularia oryzae Cav. I. Karyological and genetical studies on variation[J]. Bull Natl Inst Agric Sci, 1965, 13:231-274.( 1) 1) |
| [9] | GENOVESI A D, MAGILL C W.Heterokaryosis and parasexuality in Pyricularia oryzae Cavara[J]. Canadian Journal of Microbiology, 1976, 22(4):531-536.( 1) 1) |
| [10] | FATEMI J, NELSON R.Inter-isolate heterokaryosis in Pyricularia oryzae[J]. Phytopathology, 1978, 68:1791-1794.( 1) 1) |
| [11] | JUNHYUN J, JAEYOUNG C, GIR-WON L, et al.Experimental Evolution Reveals Genome-Wide Spectrum and Dynamics of Mutations in the Rice Blast Fungus, Magnaporthe oryzae[J]. PloS one, 2013, 8(5):967-979.( 1) 1) |
| [12] | BALHAD RE P V, FOSTER A J, TALBOT N J, et al.Identification of Pathogenicity Mutants of the Rice Blast Fungus Magnaporthe grisea by Insertional Mutagenesis[J]. Molecular Plant-Microbe Interactions, 1999, 12(2):129-142.( 1) 1) |
| [13] | 孙漱沅,金敏忠,张志明,等.水稻稻瘟病及其防治[M]. 上海:上海科学技术出版社. 1986. |
| [14] | YAMAGUCHI I. Overview on the chemical control of rice blast disease[M]//Rice Blast:Interaction with Rice and Control. Springer Netherlands, 2004:1-13.( 1) 1) |
| [15] | ZI-XUAN W, MASAHIRO Y, UTAKO Y, et al.The Pib gene for rice blast resistance belongs to the nucleotide binding and leucine-rich repeat class of plant disease resistance genes[J]. Plant Journal, 1999, 19(1):55-64.( 2) 2) |
| [16] | WANG Z X, YAMANOUCHI U, KATAYOSE Y, et al.Expression of the Pib rice-blast-resistance gene family is up-regulated by environmental conditions favouring infection and by chemical signals that trigger secondary plant defences[J]. Plant Molecular Biology, 2001, 47(5):653-661.( 1) 1) |
| [17] | FLOR H H.Current status of the gene-for-gene concept[J]. Annual review of phytopathology, 1971, 9(1):275-296.( 1) 1) |
| [18] | LI W, WANG B, WU J, et al.The Magnaporthe oryzae avirulence gene AvrPiz-t encodes a predicted secreted protein that triggers the immunity in rice mediated by the blast resistance gene Piz-t[J]. Molecular Plant-Microbe Interactions, 2009, 22(4):411-420.( 4) 4) |
| [19] | ZHANG S, WANG L, WU W, et al.Function and evolution of Magnaporthe oryzae avirulence gene AvrPib responding to the rice blast resistance gene Pib[J]. Scientific reports, 2015,(5):.( 3) 3) |
| [20] | KANG S, SWEIGARD J A, VALENT B.The PWL host specificity gene family in the blast fungus Magnaporthe grisea[J]. MPMI-Molecular Plant Microbe Interactions, 1995, 8(6):939-948.( 2) 2) |
| [21] | SWEIGARD J A, CARROLL A M, KANG S, et al.Identification, cloning, and characterization of PWL2, a gene for host species specificity in the rice blast fungus[J]. The plant cell, 1995, 7(8):1221-1233.( 2) 2) |
| [22] | FARMAN M L, LEONG S A.Chromosome walking to the AVR1-CO39 avirulence gene of Magnaporthe grisea:discrepancy between the physical and genetic maps[J]. Genetics, 1998, 150(3):1049-1058.( 2) 2) |
| [23] | ORBACH M J, FARRALL L, SWEIGARD J A, et al.A Telomeric Avirulence Gene Determines Efficacy for the Rice Blast Resistance Gene Pi-ta[J]. Plant Cell, 2000, 12(11):2019-2032.( 2) 2) |
| [24] | FUDAL I, B HNERT H U, THARREAU D, et al.Transposition of MINE, a composite retrotransposon, in the avirulence gene ACE1 of the rice blast fungus Magnaporthe grisea[J]. Fungal Genetics and Biology, 2005, 42(9):761-772.( 2) 2) |
| [25] | YOSHIDA K, SAITOH H, FUJISAWA S, et al.Association genetics reveals three novel avirulence genes from the rice blast fungal pathogen Magnaporthe oryzae[J]. The Plant Cell, 2009, 21(5):1573-1591.( 4) 4) |
| [26] | YASUDA N, TSUJIMOTO NOGUCHI M, FUJITA Y.Partial mapping of avirulence genes AVR-Pii and AVR-Pia in the rice blast fungus Magnaporthe oryzae[J]. Canadian journal of plant pathology, 2006, 28(3):494-498.( 2) 2) |
| [27] | TAKAHASHI M, ASHIZAWA T, HIRAYAE K, et al.One of two major paralogs of AVR-Pita1 is functional in Japanese rice blast isolates[J]. Phytopathology, 2010, 100(6):612-618.( 2) 2) |
| [28] | WU J, KOU Y, BAO J, et al.Comparative genomics identifies the Magnaporthe oryzae avirulence effector AvrPi9 that triggers Pi9-mediated blast resistance in rice[J]. New Phytologist, 2015, 206(4):1463-1475.( 4) 4) |
| [29] | B HNERT H U, FUDAL I, DIOH W, et al.A putative polyketide synthase/peptide synthetase from Magnaporthe grisea signals pathogen attack to resistant rice[J]. The Plant Cell, 2004, 16(9):2499-2513.( 1) 1) |
| [30] | JIA Y, MCADAMS S A, BRYAN G T, et al.Direct interaction of resistance gene and avirulence gene products confers rice blast resistance[J]. The EMBO journal, 2000, 19(15):4004-4014.( 1) 1) |
| [31] | CESARI S, THILLIEZ G, RIBOT C, et al.The rice resistance protein pair RGA4/RGA5 recognizes the Magnaporthe oryzae effectors AVR-Pia and AVR1-CO39 by direct binding[J]. The Plant Cell, 2013, 25(4):1463-1481.( 1) 1) |
| [32] | LEONG S A.The ins and outs of host recognition of Magnaporthe oryzae[M]. Genomics of Disease. Springer, 2008:199-216.( 1) 1) |
| [33] | OKUYAMA Y, KANZAKI H, ABE A, et al.A multifaceted genomics approach allows the isolation of the rice Pia-blast resistance gene consisting of two adjacent NBS-LRR protein genes[J]. The Plant Journal, 2011, 66(3):467-479.( 1) 1) |
| [34] | PARK C-H, CHEN S, SHIRSEKAR G, et al.The Magnaporthe oryzae effector AvrPiz-t targets the RING E3 Ubiquitin Ligase APIP6 to suppress pathogen-associated molecular pattern-triggered immunity in rice[J]. The Plant Cell, 2012, 24(11):4748-4762.( 1) 1) |
| [35] | WU W, WANG L, ZHANG S, et al.Stepwise arms race between AvrPik and Pik alleles in the rice blast pathosystem[J]. Molecular Plant-Microbe Interactions, 2014, 27(8):759-769.( 1) 1) |
| [36] | KANZAKI H, YOSHIDA K, SAITOH H, et al.Arms race co-evolution of Magnaporthe oryzae AVR-Pik and rice Pik genes driven by their physical interactions[J]. The Plant Journal, 2012, 72(6):894-907.( 1) 1) |
| [37] | LEE S-K, SONG M-Y, SEO Y-S, et al.Rice Pi5-mediated resistance to Magnaporthe oryzae requires the presence of two coiled-coil-nucleotide-binding-leucine-rich repeat genes[J]. Genetics, 2009, 181(4):1627-1638.( 1) 1) |
| [38] | TAKAHASHI A, HAYASHI N, MIYAO A, et al.Unique features of the rice blast resistance Pish locus revealed by large scale retrotransposon-tagging[J]. BMC plant biology, 2010, 10:175-.( 1) 1) |
| [39] | HAYASHI K, YASUDA N, FUJITA Y, et al.Identification of the blast resistance gene Pit in rice cultivars using functional markers[J]. Theoretical and applied genetics, 2010, 121(7):1357-1367.( 1) 1) |
| [40] | CHEN S, WANG L, QUE Z, et al.Genetic and physical mapping of Pi37(t), a new gene conferring resistance to rice blast in the famous cultivar St. No. 1[J]. Theoretical and applied genetics, 2005, 111(8):1563-1570.( 1) 1) |
| [41] | FUKUOKA S, SAKA N, KOGA H, et al.Loss of function of a proline-containing protein confers durable disease resistance in rice[J]. Science, 2009, 325(5943):998-1001.( 1) 1) |
| [42] | XU X, HAYASHI N, WANG C-T, et al.Rice blast resistance gene Pikahei-1(t), a member of a resistance gene cluster on chromosome 4, encodes a nucleotide-binding site and leucine-rich repeat protein[J]. Molecular breeding, 2014, 34(2):691-700.( 1) 1) |
| [43] | YIWEN D, XUDONG Z, YING S, et al.Genetic characterization and fine mapping of the blast resistance locus Pigm(t) tightly linked to Pi2 and Pi9 in a broad-spectrum resistant Chinese variety[J]. Theoretical and Applied Genetics, 2006, 113(4):705-713.( 1) 1) |
| [44] | CHEN X, SHANG J, CHEN D, et al.AB-lectin receptor kinase gene conferring rice blast resistance[J]. The Plant Journal, 2006, 46(5):794-804.( 1) 1) |
| [45] | ZHOU B, QU S, LIU G, et al.The eight amino-acid differences within three leucine-rich repeats between Pi2 and Piz-t resistance proteins determine the resistance specificity to Magnaporthe grisea[J]. Molecular plant-microbe interactions, 2006, 19(11):1216-1228.( 1) 1) |
| [46] | LI J, SUN Y, LIU H, et al.Natural variation of rice blast resistance gene Pi-d2[J]. Genetics and Molecular Research, 2015, 14(1):1235-1249.( 1) 1) |
| [47] | CHEN J, SHI Y, LIU W, et al.A Pid3 allele from rice cultivar Gumei2 confers resistance to Magnaporthe oryzae[J]. Journal of genetics and genomics, 2011, 38(5):209-216.( 1) 1) |
| [48] | LIU X, LI Y, WANG L, et al.The effect of the rice blast resistance gene Pi36 on the expression of disease resistance-related genes[J]. Chinese Science Bulletin, 2010, 55(18):1881-1888.( 1) 1) |
| [49] | JEON J-S, CHEN D, YI G-H, et al.Genetic and physical mapping of Pi5(t), a locus associated with broad-spectrum resistance to rice blast[J]. Molecular Genetics and Genomics, 2003, 269(2):280-289.( 1) 1) |
| [50] | LIU Y, LIU B, ZHU X, et al.Fine-mapping and molecular marker development for Pi56(t), a NBS-LRR gene conferring broad-spectrum resistance to Magnaporthe oryzae in rice[J]. Theoretical and applied genetics, 2013, 126(4):985-998.( 1) 1) |
| [51] | ZENG X, YANG X, ZHAO Z, et al.Characterization and fine mapping of the rice blast resistance gene Pia[J]. Science China Life Sciences, 2011, 54(4):372-378.( 1) 1) |
| [52] | FARMAN M L, ETO Y, NAKAO T, et al.Analysis of the structure of the AVR1-CO39 avirulence locus in virulent rice-infecting isolates of Magnaporthe grisea[J]. Molecular plant-microbe interactions, 2002, 15(1):6-16.( 1) 1) |
| [53] | SHARMA T R, MADHAV M S, SINGH B K, et al.High resolution mapping, cloning and molecular characterization of the Pi-k gene of rice, which confers resistance to M. grisea[J]. Molecular Genetics and Genomics, 2006, 274(6):569-578.( 2) 2) |
| [54] | CHEN J, PENG P, TIAN J, et al.Pike, a rice blast resistance allele consisting of two adjacent NBS-LRR genes, was identified as a novel allele at the Pik locus[J]. Molecular Breeding, 2015, 35(5):1-15.( 1) 1) |
| [55] | HUA L, WU J, CHEN C, et al.The isolation of Pi1, an allele at the Pik locus which confers broad spectrum resistance to rice blast[J]. Theoretical and Applied Genetics, 2012, 125(5):1047-1055.( 1) 1) |
| [56] | ASHIKAWA I, HAYASHI N, YAMANE H, et al.Two adjacent nucleotide-binding site-leucine-rich repeat class genes are required to confer Pikm-specific rice blast resistance[J]. Genetics, 2008, 180(4):2267-2276.( 1) 1) |
| [57] | YUAN B, ZHAI C, WANG W, et al.The Pik-P resistance to Magnaporthe oryzae in rice is mediated by a pair of closely linked CC-NBS-LRR genes[J]. Theoretical and applied genetics, 2011, 122(5):1017-1028.( 1) 1) |
| [58] | HAYASHI N, INOUE H, KATO T, et al.Durable panicle blast-resistance gene Pb1 encodes an atypical CC-NBS-LRR protein and was generated by acquiring a promoter through local genome duplication[J]. The Plant Journal, 2010, 64(3):498-510.( 1) 1) |
| [59] | BRYAN G T, WU K-S, FARRALL L, et al.A single amino acid difference distinguishes resistant and susceptible alleles of the rice blast resistance gene Pi-ta[J]. The Plant Cell, 2000, 12(11):2033-2045.( 1) 1) |
| [60] | REDDY P P.Recent advances in crop protection[J]. Journal of Cellular Biochemistry, 2013, 116(4):1-268.( 1) 1) |
| [61] | YOU-YONG Z, HUI F, YUN-YUE W, et al.Panicle blast and canopy moisture in rice cultivar mixtures[J]. Phytopathology, 2005, 95(4):433-438.( 1) 1) |
| [62] | LEUNG H, ZHU Y, REVILLA-MOLINA I M, et al.Using Genetic Diversity to Achieve Sustainable Rice Disease Management[J]. Plant Disease, 2003, 87(2003):1156-1169.( 1) 1) |
| [63] | 王平.水稻杂糯间栽对稻瘟病的控制作用及病菌种群结构的影响研究[D]. 成都:四川农业大学, 2007.( 1) 1) |
| [64] | RABOIN L M, RAMANANTSOANIRINA A, DUSSERRE J, et al.Two-component cultivar mixtures reduce rice blast epidemics in an upland agrosystem[J]. Plant Pathology, 2012, 61(6):1103-1111.( 1) 1) |
| [65] | KHAN M A.Molecular breeding of rice for improved disease resistance, a review[J]. Australasian Plant Pathology, 2015, 44:273-282.( 1) 1) |
| [66] | PERUMALSAMY S, BHARANI M, SUDHA M, et al.Functional marker-assisted selection for bacterial leaf blight resistance genes in rice (Oryza sativa L.)[J]. Plant Breeding, 2010, 129(4):400-406.( 1) 1) |
| [67] | GOUDA P K, SAIKUMAR S, VARMA C M K, et al.Marker-assisted breeding of Pi-1 and Piz-5 genes imparting resistance to rice blast in PRR78, restorer line of Pusa RH-10 Basmati rice hybrid[J]. Plant Breeding, 2013, 132(1):61-69.( 1) 1) |
| [68] | 李锦江,肖友伦,孟秋成,等.水稻抗稻瘟病和抗白叶枯病基因聚合品系抗性分析[J]. 杂交水稻, 2012, (5):59-66.( 1) 1) |
| [69] | 杜太宗,余显权,朱速松,等.稻瘟病抗性基因Pi1与Pi9聚合材料的抗性鉴定[J]. 贵州农业科学, 2015, (4):35-38.( 1) 1) |
| [70] | 郑卓之, 李魏, 戴良英.水稻抗稻瘟病分子遗传研究进展[J]. 作物研究, 2013, 27(2):180-184.( 1) 1) |
 2016, Vol. 31
2016, Vol. 31
