多溴联苯醚polybrominated diphenyl ethers,PBDEs是一类新型的持久性有机污染物,2009年被正式列入《斯德哥尔摩公约》[1]。PBDEs阻燃效率高,热稳定性好,常被应用于电力行业家用电器等领域[2],这些电子产品使用及废旧电子设备的拆卸处理过程,是PBDEs进入环境的主要途径[3]。欧寿铭等[4]对厦门地区沉积物进行了监测,发现沉积物中总PBDE最高值为厦门第一码头,含量2.06 ng·g-1。PBDEs主要以低溴代联苯醚的形式大量蓄积在生物体内。2,2′,4,4′-四溴联苯醚(2,2′,4,4′-tetra-bromodiphenylether,BDE-47)是PBDEs中主要存在的一种低溴代联苯醚[5]。周明莹等[6]对青岛胶州湾养殖水体中的PBDEs进行了调查,主要检测出BDE-47、BDE-17、BDE-85、BDE-99等4种,并且BDE-47为主要的污染物,含量达到183.5 pg·L-1。
PBDEs具有亲脂性和生物累积等特点[7],可以通过食物链放大,对高营养级的生物造成影响。Verslycke 等[8]检测出Scheldt 河河口的沉积物中PBDEs的含量为14~22 ng·g-1,栖息在河里的虾体内PBDEs为1 765~2 962 ng·g-1(脂肪),PBDEs在鱼虾体内大量的蓄积,含量远远超过该地区环境中的含量。当PBDEs的蓄积量达到一定程度时,会引发生物体的生殖发育毒性,甲状腺毒性,神经毒性,免疫毒性等,对生物造成损害。
双齿围沙蚕Perinereis aibuhitensis,属滩涂生物中的优势种,喜穴居于风浪平静、营养丰富的潮间带泥沙滩,数量多[9-10],丰富度高,稳定性好,地理分布广,并且对海洋环境中持久性有机污染物反应敏感,同时具有极强耐受性,具有重要的生态学研究价值[11]。因此常常选用双齿围沙蚕来评估滩涂及海洋沉积物的污染情况[8, 12-13] 。
抗氧化防御系统在需氧生物体内具有十分重要的作用,其中抗氧化酶在清除氧自由基和过氧化氢、遏制或减少羟自由基形成、保护机体免受自由基损害等方面具有关键作用。在正常的生理状态下,动物体内的活性氧簇(reactive oxygen species,ROS: O2·、H2O2 及HO2·、·OH)种类处于动态平衡状态。当有机体受到外源刺激时,ROS大量产生,引起细胞功能的紊乱,从而使抗氧化防御系统发挥作用,防止氧化损伤的产生。
许超群等[14]用0.25、1.25 、6.25 μg·L-1 的BDE- 47对菲律宾蛤仔Ruditapes philippinarum进行处理,鳃丝和消化盲囊GSH含量分别被显著诱导和抑制(P<0.05)。徐湘博[15]将赤子爱胜蚓Eisenia fetida暴露于10、50、100、200 mg·kg-1的BDE-47中,在暴露阶段,GST活力变化不存在显著差异(P >0.05)。赵欢等[16]将双齿围沙蚕暴露在5 μg·L-1和50 μg·L-1 B(a)P中,GPx酶活性与B(a)P质量浓度和暴露时间成正相关(P<0.01)。周科[17]将铜锈环棱螺Bellamya aeruginosa的肝胰脏暴露在40 ng·g -1、160 ng·g-1 和640 ng·g-1 BDE-47污染沉积物中,SOD活性和CAT活性有较显著的变化趋势。范灿鹏等[18]将雌性剑尾鱼Xiphophorus helleri暴露在BDE-47下,MDA含量先下降后逐渐上升。
本研究拟通过测定在BDE-47胁迫下谷胱甘肽硫转移酶(GST)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)的活力以及谷胱甘肽(GSH)、丙二醛(MDA)的含量在双齿围沙蚕体内的变化,根据其含量和活性变化的敏感性,从而为判定这些指标是否可以用作BDE-47污染的生物标志物提供依据。
1 材料与方法 1.1 试验材料供试双齿围沙蚕购于宁德市霞浦县下土鼻海蜈蚣养殖场,暂养于装有滩涂沉积物的塑料箱(100 cm×40 cm×10 cm)内5~10 d,箱内沉积物的高度为7~8 cm,期间及时挑出死亡个体。暂养采用过滤的海水,海水盐度为(30±2),pH为7~8,温度为(25.00 ± 0.50)℃,日换水1~2次,投喂广东海大集团股份有限公司的凡纳滨对虾的1号配合饲料1~2次。在试验前1 d停止投喂饵料,挑取形态完整、健康活泼、规格相近的沙蚕[体长(5.0±0.5)cm、体重(0.5±0.2)g]进行试验。
BDE-47购自武汉凯美克化学科技有限公司,纯度为98%;DMSO分析纯;TP、GPX、GSH、GST、CAT、MDA、SOD试剂盒均购自南京建成生物工程研究所。
1.2 试验方法采用DMSO分析纯作为BDE-47的助溶剂,配制质量浓度为10 mg·L-1的DMSO储备液,试验时分别用自然海水稀释所需的浓度,且各处理组DMSO的体积分数均为0.001% 。
1.2.1 急性毒性试验根据预试验的处理结果,设置了5、10、20、60、100 mg·L-14个处理组(此浓度由BDE-47直接配制),另外设置1个空白对照组和DMSO对照组,1个100 mL烧杯中加20 mL BDE-47溶液,放入1条沙蚕,每个处理组设置30条沙蚕。试验期间不投喂,8:00和20:00各全部更新1次污染物溶液,观察并记录24、48、72、96 h沙蚕的死亡个体数。计算96h-LC50和95%置信区间。
1.2.2 暴露试验及抗氧化防御系统测定BDE-47的浓度梯度设置为双齿围沙蚕96h-LC50 的 1/4、1/8、1/16,另外设置DMSO 对照组和空白对照组,每个处理组共30条沙蚕,每个烧杯1尾沙蚕,分别在 1、4、7、14 d取样,各处理组在胁迫14 d后,再进行5 d的净水恢复(recovery 5,r 5),于第19 d取样。 在每个时间节点,从每个处理组之中随机挑选取3条沙蚕作为3个重复,分别进行测定,每条沙蚕取组织0.2~1.0 g,加入0.86%生理盐水,生理盐水的体积总量是组织块重量的9倍,低温匀浆。将匀浆液于4℃、2 000 r·min-1 条件下离心15 min。取上清液,严格按照南京建成生物工程研究所提供的试剂盒说明书进行抗氧化酶抗氧化防御酶系统指标的测定。蛋白含量采用考马斯亮蓝法,以试剂盒蛋白标准液为标准蛋白,同样按照试剂盒说明进行测定。
1.3 数据统计分析运用Excel对数据进行初步处理,采用SPSS 19.0 单因素方差分析(ANOVA)对数据进行LSD多重分析。“*”表示处理组与对照组差异显著(P<0.05);“**”表示处理组与对照组差异极显著(P<0.01)。采用Origin 8.0软件作图。
2 结果与分析 2.1 BDE-47对双齿围沙蚕的急性毒性的影响方差分析结果表明,0.001%的DMSO助溶剂对照组与空白对照组中的双齿围沙蚕各指标的响应无显著差异(P>0.05),因此,选取助溶剂作为对照组。
双齿围沙蚕暴露在BDE-47溶液中,开始时游动缓慢,逐渐会有断尾的现象,吻部会出现肿胀,后期表皮破裂,虫体泛白腐烂直至死亡。BDE-47对双齿围沙蚕的 96h-LC50为31.24 mg·L-1,95%置信度为 15.73~45.12 mg·L-1。
2.2 BDE-47对双齿围沙蚕抗氧化酶活性的影响如图 1所示,在暴露期间GSH含量与对照组比较均无显著变化。净水恢复期时,GSH含量反而被诱导显著升高,2、4 mg·L-1处理组极显著性升高(P<0.01),8 mg·L-1组显著性升高(P<0.05)。
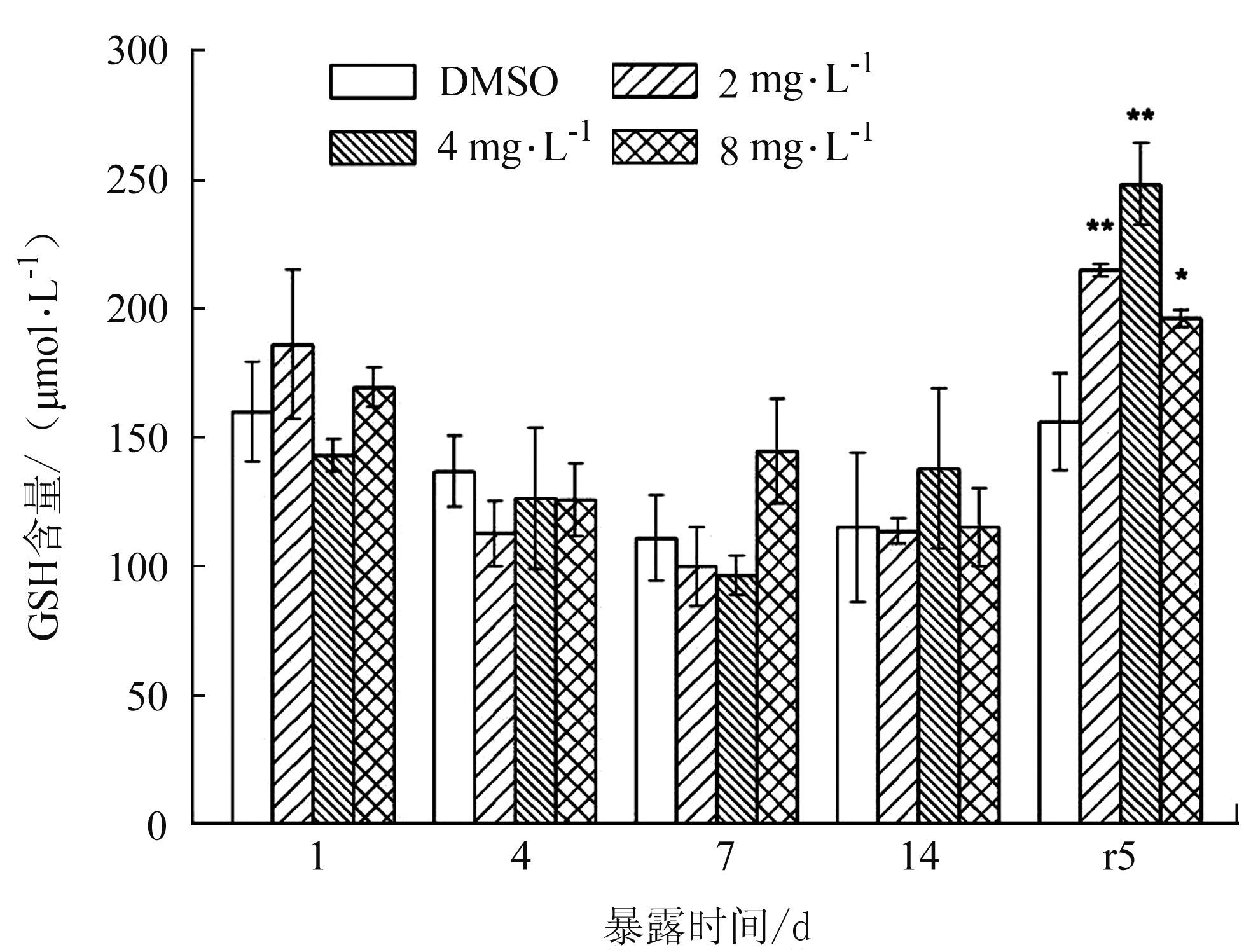
|
图 1 BDE-47对双齿围沙蚕GSH含量的影响 Figure 1 The effect of BDE-47 on the GSH quantity of P.Aibuhitensis |
如图 2所示,与对照组比较GST活力总体上没有显著变化,仅8 mg·L-1组在14 d极显著性升高(P<0.01),净水恢复期,4 mg·L-1被诱导极显著性升高(P<0.01)。
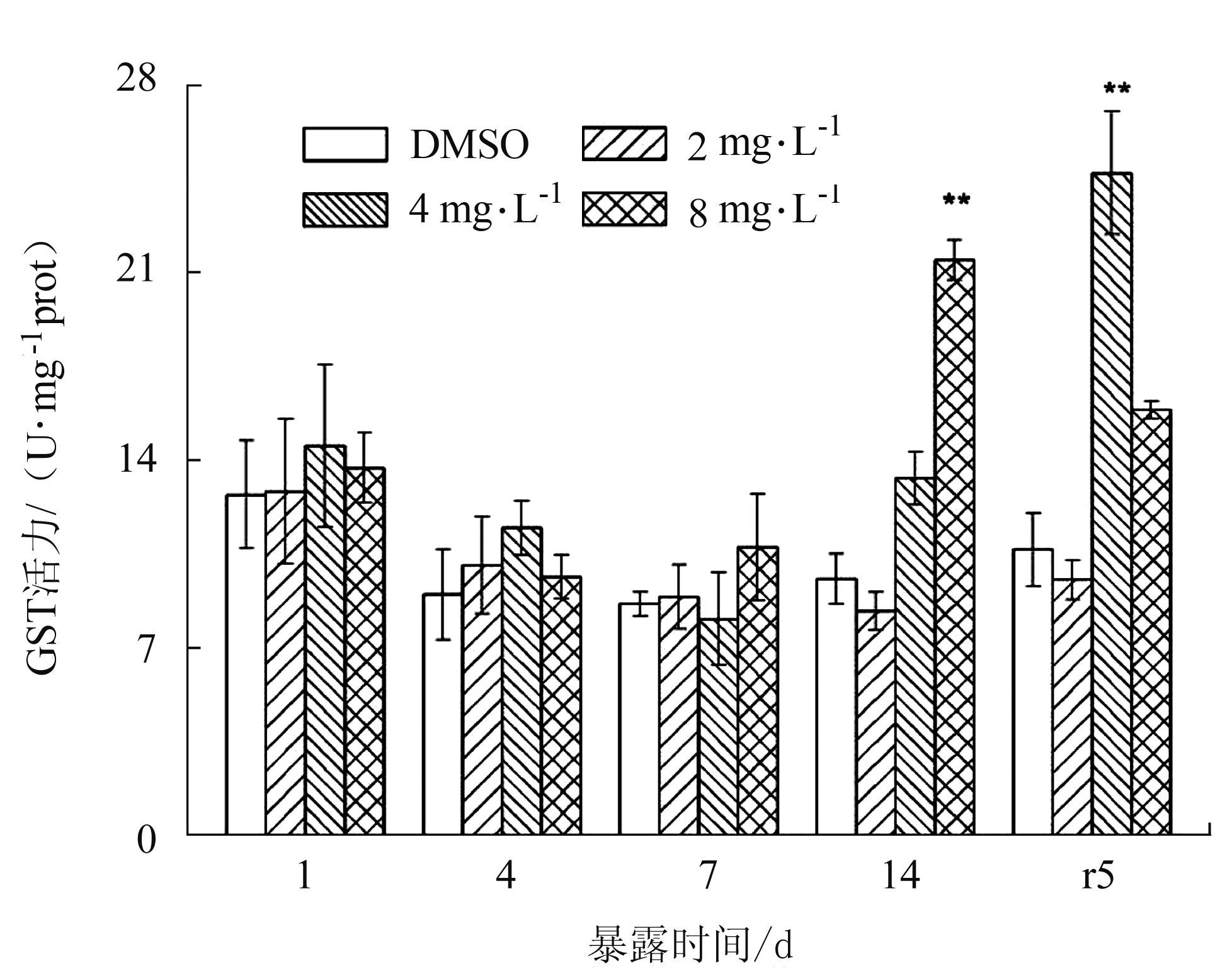
|
图 2 BDE-47对双齿围沙蚕GST活力的影响 Figure 2 The effect of BDE-47 on the GST activity of P.aibuhitensis |
如图 3所示,暴露1 d时,4 mg·L-1处理组GPx活力显著性升高(P<0.05),2 mg·L-1的GPx活性在胁迫第7~14 d呈上升趋势(P<0.05),在净水恢复阶段,2、4 mg·L-1处理组显著性升高(P<0.05),8 mg·L-1组极显著性升高(P<0.01)。

|
图 3 BDE-47对双齿围沙蚕GPx活力的影响 Figure 3 The effect of BDE-47 on the GPx activity of P.aibuhitensis |
SOD活力随时间的变化如图 4所示:暴露1 d时,4、8 mg·L-1两组SOD酶活力显著性下降(P<0.05),暴露4 d时,2 mg·L-1处理组,SOD活力继续下降,而4、8 mg·L-1处理组SOD活力升高至与对照组一致,无显著变化;暴露7 d时,8 mg·L-1组活力显著升高(P<0.05),而2、4 mg·L-1两组SOD活力均无显著性变化。总体上看,在胁迫前期(1~7 d)SOD活力被诱导升高。14 d时,4 mg·L-1、8 mg·L-1处理组的SOD活力与对照组的比较,分别被显著(P<0.05)和极显著(P<0.01)地抑制。净水恢复期,各处理组SOD活力与对照组基本一致,且差异不显著(P >0.05)。
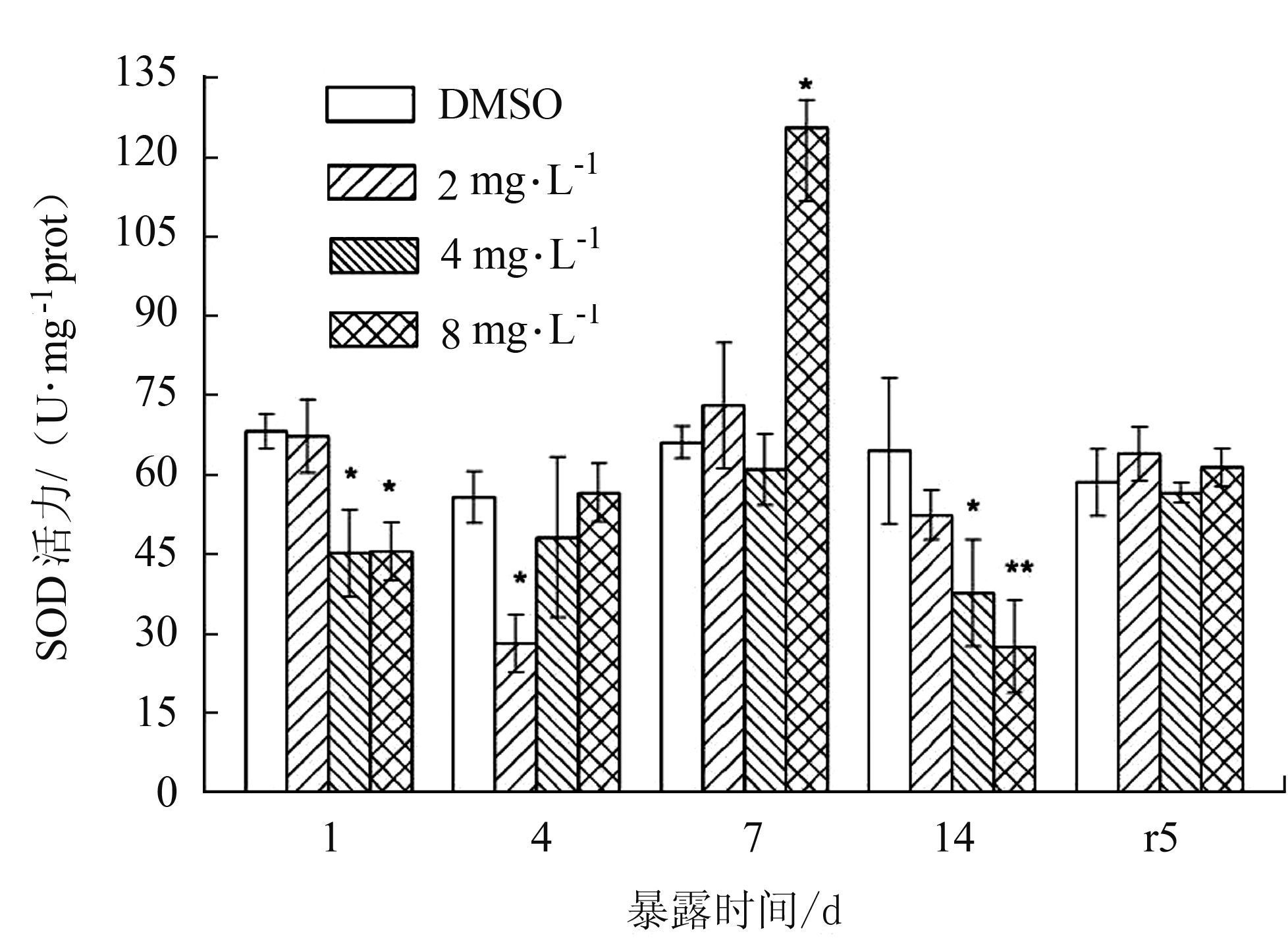
|
图 4 BDE-47对双齿围沙蚕SOD活力的影响 Figure 4 The effect of BDE-47 on the SOD activity of P.aibuhitensis |
MDA含量随时间的变化如图 5所示。暴露1 d时,MDA含量与对照组相比,均被诱导升高(P<0.05),且4 mg·L-1极显著升高(P<0.01)。暴露4、7 d时,2 mg·L-1、4 mg·L-1两组均无显著变化,8 mg·L-1显著升高(P<0.05)。总体上看,在暴露4~14 d期间,MDA含量无显著变化(P>0.05),仅7 d的 8 mg·L-1组活力显著升高(P<0.05)。在净水恢复期,2 mg·L-1处理组MDA含量极显著性升高(P<0.01),4 mg·L-1处理组MDA含量显著升高(P<0.05)。
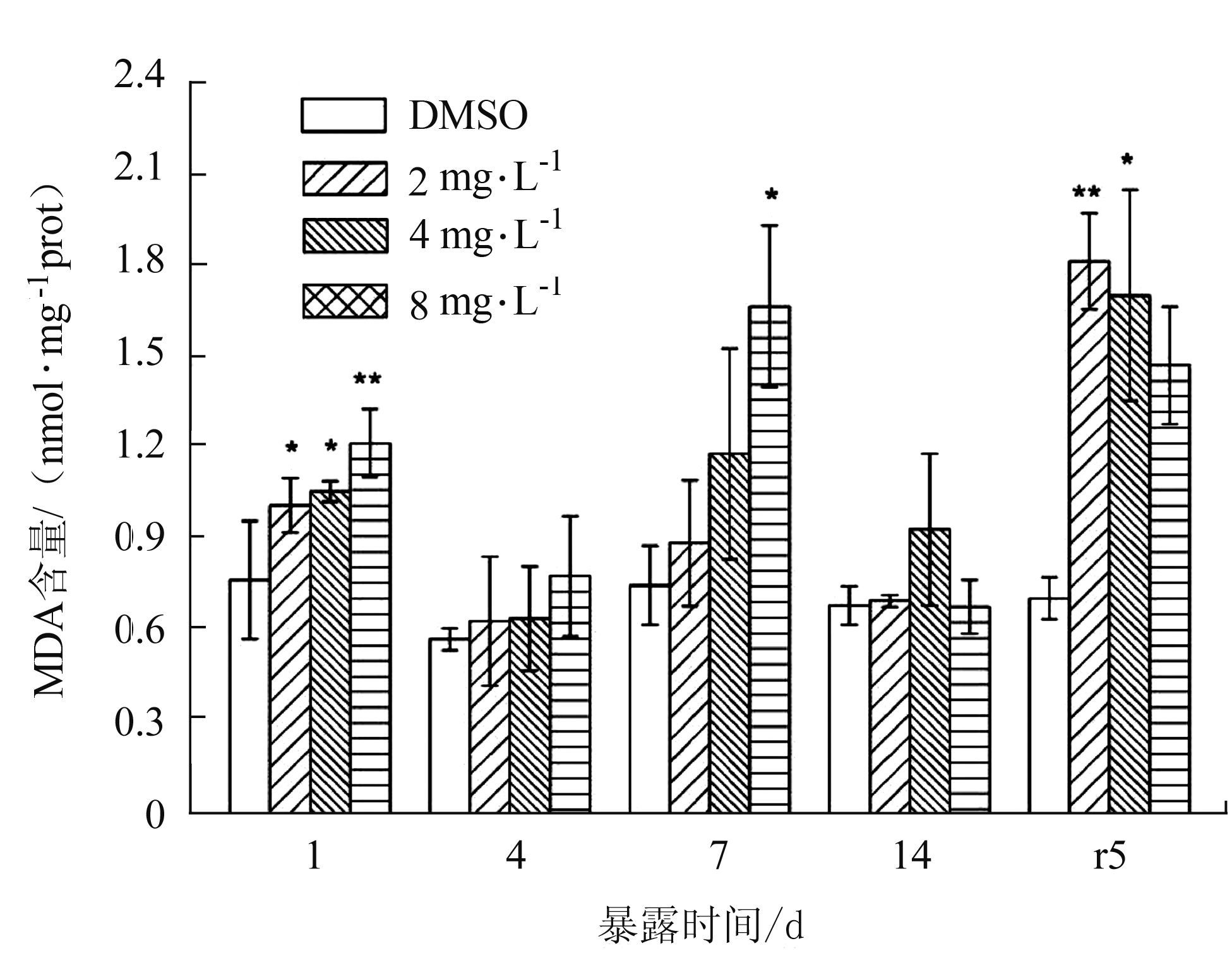
|
图 5 BDE-47对双齿围沙蚕MDA含量的影响 Figure 5 The effect of BDE-47 on the MDA quantity of P.aibuhitensis |
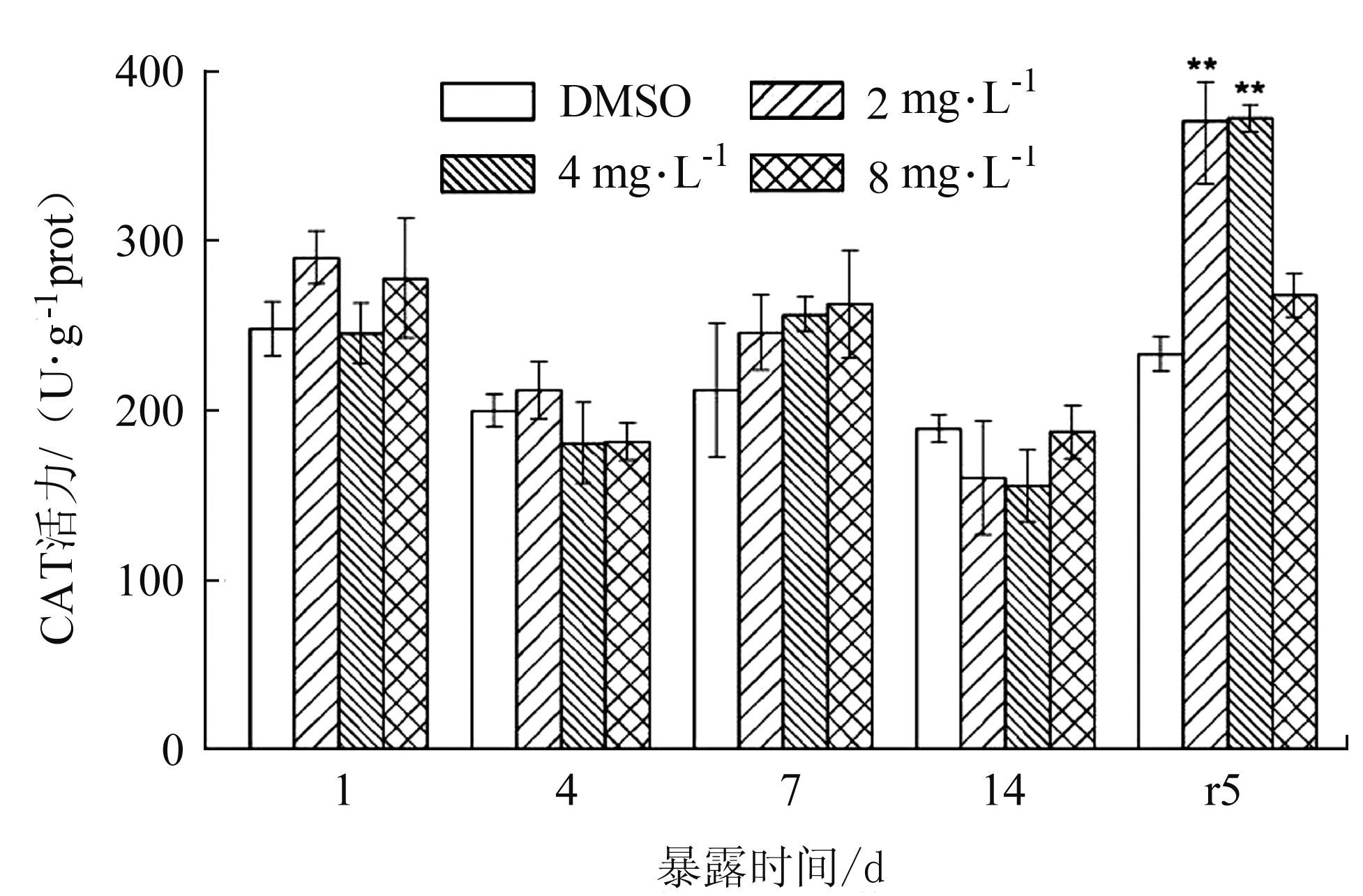
如图 6所示,在暴露期间,各处理组的CAT活力与对照组的相比,均差异不显著(P>0.05),在净水恢复期,2、4 mg·L-1极显著高于对照组(P<0.01),8 mg·L-1处理组无显著变化(P>0.05)。
|
图 6 BDE-47对双齿围沙蚕CAT活力的影响 Figure 6 The effect of BDE-47 on the CAT activity ofP.aibuhitensis |
在急性毒性试验中,随着暴露时间的延长,沙蚕会出现断尾现象。Lucan-Bouché等[19]研究表明:沙蚕的断尾现象是一种自我保护机制,来消除体内不断积累的有害物质。BDE-47对太平洋真宽水蚤Eurytemora pacifica的96 h-LC50为57 μg·L-1,对日本虎斑猛水蚤Tigriopus japonicus的96 h-LC50为851 μg·L-1[20];而BDE-47对剑尾鱼Xiphophorus helleri 的96h-LC50为2.75 mg·L-1[18]。本研究结果表明,BDE-47对双齿围沙蚕的96 h-LC50为31.24 mg·L-1,这说明不同种类的水生生物对BDE-47的敏感性有很大差异,而沙蚕的96 h-LC50之所以达到这么高,可能是因为沙蚕对 BDE-47 的耐受性较强;沙蚕自身会分泌黏液形成一个保护膜,从而减少环境中 BDE-47 对沙蚕产生毒性,还有可能是机体自身代谢,会使部分的毒物排除体外。
3.2 BDE-47对双齿围沙蚕GSH含量和GST、GPx活性的影响GSH是水溶性抗氧化剂,具有重要的抗氧化作用,其结构中的活性基团-巯基,易与体内自由基、重金属等毒素结合,参与生物体内的生物转化过程,具有整合解毒、保护生物体内膜系统的作用。可以清除细胞内被诱导产生的过量H2O2;能直接与ROS发生非酶促反应;同时还是GST的底物。GST是生物体内重要的II相代谢酶之一,GST在清除体内自由基的同时还可以调控GSH发挥作用,GST的活性能够反映出生物机体抗氧化能力[21]。GPx可以催化GSH,把H2O2还原为H2O,其自身被氧化成为氧化型谷胱甘肽(GSSG),GSSG受到谷胱甘肽还原酶(GR)的催化作用,被还原成GSH,使体内自由基的清除反应能够持续进行。
在本研究中,GSH含量和GST活力总体上没有显著变化,仅GST活力的8 mg·L-1组在第14 d极显著性升高(P<0.01)。说明在1~14 d的受胁迫期间双齿围沙蚕GSH和GST未发挥作用。随着胁迫时间的延长,ROS在体内不断的积累,可能在净水恢复期GSH和GST才发挥作用清除体内ROS,因此GSH含量显著性升高,8 mg·L-1组的GST活力显著性升高。2 mg·L-1组的GPx活性在胁迫第7~14 d呈上升趋势,在胁迫后期发挥作用,同样净水恢复期,GPx活性显著升高来清除体内积累的ROS。
在暴露期间,各处理组的GSH含量和GST、GPx活力与对照组的相比较,总体上均差异不大,但在恢复期,此3个指标总体上被显著诱导,这可能是由于胁迫时间较短,它们尚未对BDE-47做出响应的缘故,所以,不宜将它们作为BDE-47污染的早期预警生物标志物。
3.3 BDE-47对双齿围沙蚕SOD、CAT活性和MDA含量的影响SOD是生物体内一种重要的抗氧化酶,能够催化体内的O2-发生歧化反应生成O2和 H2O2[22],清除细胞内新陈代谢等过程中产生的氧自由基,并能稳定细胞膜。SOD的活力间接反映了机体清除氧自由基的能力。丙二醛(MDA)是ROS攻击细胞膜磷脂中多不饱和脂肪酸后发生膜脂质过氧化的主要产物之一,可加剧膜损伤,是细胞发生脂质过氧化反应中最具代表性的产物,其含量可直接反应脂质过氧化的程度,间接反应自由基对机体的损伤程度[23-24]。
本研究在暴露1 d时,沙蚕细胞受到胁迫,产生大量的ROS,使抗氧化防御系统受到损伤,4、8 mg·L-1两组SOD酶活力下降,总体上看,4、8 mg·L-1在胁迫前期(1~7 d)SOD活力呈升高趋势,说明此时抗氧化防御系统发挥作用,清除了沙蚕受到胁迫产生的ROS,第7 d的8 mg·L-1浓度可能过高,需要产生大量的SOD清除体内ROS,因此显著性升高。随着暴露时间的继续延长,持续胁迫14 d时,ROS在沙蚕体内累积,需要消耗大量的SOD酶来清除。因此,4、8 mg·L-1 两组SOD活力受到显著抑制(P<0.05)。沙蚕在受到胁迫时SOD活力会受到影响,但自身具有恢复能力,在外界刺激消失时恢复到了自然水平[25]。SOD活力的变化主要是在前期和后期,而胁迫中期,总体上无显著差异。
在本研究之中,与SOD活力相对应,MDA含量暴露1 d时被诱导升高,可能是因为ROS使机体发生脂质过氧化反应,导致MDA大量的产生。随后,可能是抗氧化防御系统发挥作用清除了过量的ROS,MDA含量降低,并且在胁迫4~14 d机体所产生的 ROS不够引起脂质过氧化反应,因此MDA含量无显著性变化。但第7 d的8 mg·L-1可能是因为浓度过高,才会导致脂质过氧化产物短时间内不能完全清除,因此显著升高。在净水恢复期,BDE-47胁迫消失,MDA含量持续升高,可能是由于细胞脂质过氧化反应,导致细胞膜受到严重破坏,可能已经无法维持生物膜功能的完整性。MDA含量对BDE-47的响应主要是在胁迫初期(1 d),后期总体上无显著变化。
CAT酶是以铁卟啉为辅基,能分解羟自由基和H2O2,从而减轻活性氧对机体细胞的氧化损伤[26]。在暴露期间,CAT 活力处理组与对照组相比较均没有显著变化(P >0.05),只在净水恢复期CAT活力整体上呈现升高的趋势,可能是沙蚕体内积累的过量ROS需要CAT发挥作用清除,因此CAT活力升高。
从总体结果看,除了SOD活力外,其他指标都是在恢复期显著诱导,这可能是由于胁迫期间产生的ROS需要经历一定时间,并在体内累积达到了一定的量,才需要抗氧化防御系统来清除,其他指标在胁迫后期才逐渐发挥作用所致。
抗氧化防御系统指标是防御型生物标志物,对机体氧化应激比较敏感。通过本研究可以得出以下结论:① GSH含量与GST、GPx、CAT活力对照组相比,总体上差异不显著(P >0.05),所以不宜作为监测环境污染的早期预警的生物标志物;②MDA含量和SOD活力的显著性变化主要是在胁迫初期(1 d),因此MDA含量和SOD活力可以作为潜在的生物标志物。
| [1] |
董亮, 张秀蓝, 史双昕, 等.
新型持久性有机污染物分析方法研究进展[J]. 中国科学:化学 , 2013, 43 (3) : 336–350.
( 0) 0)
|
| [2] |
ALAEE M, ARIAS P, SJDIN A, et al.
An overview of commercially used brominated flame retardants,their applications,their use patterns in different countries/regions and possible modes of release[J]. Environment International , 2003, 29 (6) : 683–689.
DOI:10.1016/S0160-4120(03)00121-1 ( 0) 0)
|
| [3] |
DARNERUD P O, VILUKSELA M.
Polybrominated Diphenyl Ethers:Occurrence,Dietary Exposure,and Toxicology[J]. Environmental Health Perspectives , 2001, 109 (S1) : 49–68.
DOI:10.1289/ehp.01109s149 ( 0) 0)
|
| [4] |
欧寿铭.
厦门港和筼筜湖沉积物中多溴联苯醚类防火剂(PBDEs)的色谱-质谱联机同位素稀释法测定[J]. 福建分析测试 , 2006, 15 (1) : 1–3.
( 0) 0)
|
| [5] |
CHRISTENSEN J H, GLASIUS M, P CSELI M, et al.
Polybrominated diphenyl ethers (PBDEs) in marine fish and blue mussels from southern Greenland[J]. Chemosphere , 2002, 47 (6) : 631–638.
DOI:10.1016/S0045-6535(02)00009-7 ( 0) 0)
|
| [6] |
周明莹, 张惠珍, 夏斌, 等.
多溴联苯醚在胶州湾养殖水域含量水平与分布[J]. 海洋环境科学 , 2010, 29 (6) : 884–8.
( 0) 0)
|
| [7] |
CHEN J W, HARNER T, YANG P, et al.
Quantitative predictive models for octanol-air partition coefficients of polybrominated diphenyl ethers at different temperatures[J]. Chemosphere , 2003, 51 (7) : 577–584.
DOI:10.1016/S0045-6535(03)00006-7 ( 0) 0)
|
| [8] |
VERSLYCKE T A, A DICK V, KATRIEN A, et al.
Flame retardants,surfactants and organotins in sediment and mysid shrimp of the Scheldt estuary (The Netherlands)[J]. Environmental Pollution , 2005, 136 (1) : 19–31.
DOI:10.1016/j.envpol.2004.12.008 ( 0) 0)
|
| [9] |
JIE H.
Study on the Macrobenthic Abundance and Biomass in Bohai Sea[J]. Journal of Ocean University of Qingdao , 2001, 31 (8) : 89–96.
( 0) 0)
|
| [10] |
周进, 李新正.
中国海多毛纲动物研究现状及展望[J]. 海洋科学 , 2011 (6) : 82–89.
( 0) 0)
|
| [11] |
盖珊珊.山东沿海不同地理群体双齿围沙蚕(Perinereis aibuhitensis)的早期发育及遗传多样性研究[D].青岛:中国海洋大学,2012.
http://cdmd.cnki.com.cn/article/cdmd-10423-1012504505.htm ( 0) 0)
|
| [12] |
LECOEUR S, VIDEMANN B, BERNY P.
Evaluation of metallothionein as a biomarker of single and combined Cd/Cu exposure in Dreissena polymorpha[J]. Environmental Research , 2004, 94 (2) : 184–191.
DOI:10.1016/S0013-9351(03)00069-0 ( 0) 0)
|
| [13] |
BAT L.
A review of sediment toxicity bioassays using the amphipods and polychaetes[J]. Turkish Journal of Fisheries&Aquatic Sciences , 2005 (2) : 119–139.
( 0) 0)
|
| [14] |
许超群, 潘鲁青, 王琳.
四溴联苯醚(BDE-47)对菲律宾蛤仔组织解毒代谢酶活力与DNA损伤的影响[J]. 海洋环境科学 , 2011, 30 (5) : 653–658.
( 0) 0)
|
| [15] |
徐湘博, 史雅娟, 吕永龙, 等.
2,2',4,4'-四溴联苯醚对赤子爱胜蚓的抗氧化酶、代谢酶及其基因表达的影响[J]. 环境科学学报 , 2014, 34 (11) : 2948–2955.
( 0) 0)
|
| [16] |
赵欢, 赵新达, 岳宗豪, 等.
苯并(a)芘对双齿围沙蚕抗氧化酶活性和细胞色素P450基因表达的影响[J]. 大连海洋大学学报 , 2014 (4) : 342–346.
( 0) 0)
|
| [17] |
周科, 马陶武, 朱程, 等.
2,2',4,4'-四溴联苯醚(BDE-47)污染沉积物对铜锈环棱螺肝胰脏的SOD、CAT和EROD活性的影响[J]. 环境科学学报 , 2010, 30 (8) : 1666–1673.
( 0) 0)
|
| [18] |
范灿鹏, 王奇, 刘昕宇, 等.
四溴联苯醚对剑尾鱼毒性及其抗氧化系统的影响[J]. 环境科学学报 , 2011, 31 (3) : 642–648.
( 0) 0)
|
| [19] |
LUCAN-BOUCH M L, BIAGIANTI-RISBOURG S, ARSAC F, et al.
An original decontamination process developed by the aquatic oligochaete Tubifex tubifex exposed to copper and lead[J]. Aquatic Toxicology , 1999, 45 (1) : 9–17.
DOI:10.1016/S0166-445X(98)00091-5 ( 0) 0)
|
| [20] |
徐风风.四溴联苯醚(BDE-47)对两种海洋桡足类的毒性影响[D].青岛:中国海洋大学,2013.
http://cdmd.cnki.com.cn/article/cdmd-10423-1013368557.htm ( 0) 0)
|
| [21] |
聂凤琴.多溴联苯醚对鲫鱼分子毒理效应的研究[D].南京:南京农业大学,2009.
http://cdmd.cnki.com.cn/article/cdmd-10307-2010174133.htm ( 0) 0)
|
| [22] |
董亮, 何永志, 王远亮, 等.
超氧化物歧化酶(SOD)的应用研究进展[J]. 中国农业科技导报 , 2013 (5) : 53–58.
( 0) 0)
|
| [23] |
陈汉, 王慧君, 李学锋, 等.
甲基苯丙胺对大鼠脑组织中NO,SOD和MDA的影响[J]. 中国药物依赖性杂志 , 2007, 16 (2) : 102–104.
( 0) 0)
|
| [24] |
PELLERIN-MASSICOTTE J.
Oxidative processes as indicators of chemical stress in marine bivalves[J]. Journal of Aquatic Ecosystem Stress&Recovery , 1994, 3 (2) : 101–111.
( 0) 0)
|
| [25] |
刘嫦娥, 段昌群, 王旭, 等.
丁草胺和乙草胺对蚯蚓CAT和SOD活性的影响[J]. 环境化学 , 2008, 27 (6) : 756–761.
( 0) 0)
|
| [26] |
陈家长, 杨光, 孟顺龙, 等.
不同浓度阿维菌素对鲤鱼过氧化氢酶和谷胱甘肽-S-转移酶活性的影响[J]. 生态学杂志 , 2010, 29 (4) : 680–686.
( 0) 0)
|
 2016, Vol. 31
2016, Vol. 31
