中国水仙Narcissus tazetta var. chinensis栽培历史悠久,是我国传统十大名花之一为多年生单子叶植物,属于石蒜科水仙属。按照产地不同中国水仙可分为漳州水仙、平潭水仙和崇明水仙等。目前国内外对水仙优良品种选育、种质鉴定、资源保护、栽培、种球储运和生理活性成分提取等方面开展大量研究,而对水仙花抗性生理方面研究较少,尤其是对重金属耐性方面研究几乎空白[1-2]。
随着人类社会快速发展,大量未经处理的废水、废气和废渣排入环境,使得水体、土壤和大气中重金属含量急剧升高。重金属元素能够对植物产生直接和间接伤害,机制在于重金属与植物体内蛋白巯基结合或取代某些基团造成蛋白活性抑制或结构破坏,重金属离子抑或对植物代谢产生渗透胁迫等。镉属于植物非必需元素,是生物毒性最强的重金属之一,且生物迁移性较强,极易被植物体吸收累积。镉对植物体造成的伤害包括抑制植物细胞分裂、损害植物超微结构、抑制叶绿素合成和光合电子传递、损害质膜和拮抗营养元素吸收等[3-4]。镉胁迫对植物造成的氧化胁迫是镉毒害机理之一,许多研究显示镉导致植物体内活性氧自由基积累,造成蛋白质结构破坏和生物膜系统损伤,对植物造成严重伤害[5-8]。为探明水仙花对镉的响应机制,本研究通过水培试验研究镉胁迫对水仙花生长、抗氧化系统和镉在水仙花中的积累特性,以期为水仙花栽培和园林绿化中筛选重金属修复植物提供理论参考和依据。
1 材料与方法 1.1 试验设计将2年生水仙种球(产地漳州)用Hoagland营养液进行水培。水培介质中添加Cd、Cl2 原溶液,使最后介质镉的质量浓度分别为0.5、2、4、8和25 mg·L-1,记为Cd 0.5、Cd 2、Cd 4、Cd 8 和Cd 25,亦设置镉浓度为0 mg·L-1对照处理(记为Cd 0)。水培溶液每3 d换1次,并用1 mol·L-1HCl 或1 mol·L-1NaOH 调节pH至6.0~ 6.5。处理8周后,植株按处理收获,用去离子水冲洗干净后选取新鲜根系进行下列试验。
1.2 丙二醛含量测定选取新鲜植物样(根系),剪碎混匀后,采用硫代巴比妥酸显色法测定根系中丙二醛含量[7]。
1.3 抗氧化酶和过氧化氢含量测定SOD、POD和H2O2分别采用苏州科铭生物技术有限公司生产的超氧化物歧化酶测试盒、过氧化物酶测试盒和过氧化氢测试盒测定。
1.4 非蛋白巯基和谷胱甘肽含量测定NPT含量测定采用Rama提出的方法[9],称取0.2 g植物鲜样,磺基水杨酸冰浴研磨后离心,定容后,加入Tris-HCl(pH 8.2)和5,5′-双二硫-2硝基苯甲酸反应体系,反应20 min后于412 nm处测定吸光值,以GSH为巯基标样。
采用TDNB(二硫代双-二硝基苯甲酸)法测定谷胱甘肽含量[10],称取1.0 g植物鲜样,冰浴研磨,加入磷酸钾缓冲液和 TDNB试剂,反应5 min后于412 nm处测定吸光值,计算结果。
1.5 数据处理文中各生理指标测定均为3次重复平均值。应用Excel 2007整理试验数据,运用SPSS 11.0软件对数据进行单因素方差分析,并进行多重比较(SSR法),显著性水平为P<0.05。数据作图采用Origin 8.0软件。
2 结果与分析 2.1 镉对水仙根系丙二醛含量的影响镉对水仙丙二醛含量的影响如图 1所示。与对照处理相比,镉处理胁迫均显著增加根系丙二醛含量,根系丙二醛含量随镉处理浓度的升高而升高,Cd 0.5处理下丙二醛含量比对照处理高77.5%,Cd 8处理下丙二醛含量高于对照634.6%。由此可见低浓度镉胁迫已对水仙根系产生氧化胁迫,氧化胁迫随着镉处理浓度的增加而增加。
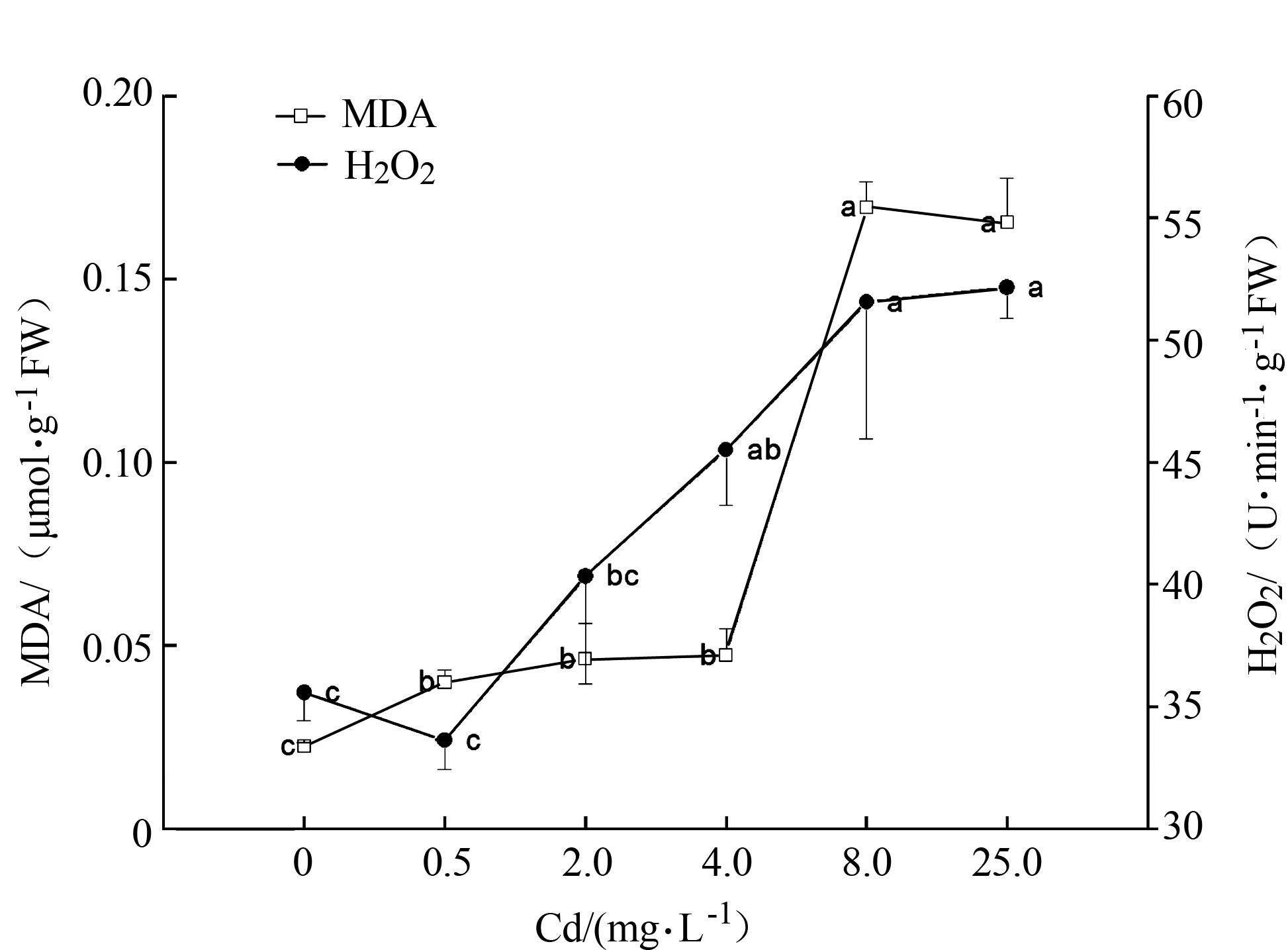
|
图 1 镉处理对水仙膜脂过氧化影响 Figure 1 Accumulation of MDA and H2O2 in roots of daffodil plants exposed to exogenous Cd |
图 1显示镉处理显著影响水仙根系中过氧化氢含量。与对照相比,Cd 0.5和Cd 2处理对根系过氧化氢含量影响不显著,镉处理浓度大于等于4 mg·L-1胁迫下均显著增加根系过氧化氢含量,其含量随镉处理浓度增加而增加,Cd 4处理下过氧化氢含量比对照高27.9%,Cd 8处理与Cd 25处理间过氧化氢含量差异不大,分别比对照高44.9%和46.6%。
2.3 镉对水仙根系SOD活性影响图 2显示镉处理对根系SOD活性的影响,随着镉处理浓度的增加SOD活性呈现先下降而后升高的趋势,其中Cd 2处理显著降低其活性,比对照降低16.3%,其他处理没有显著影响SOD活性。
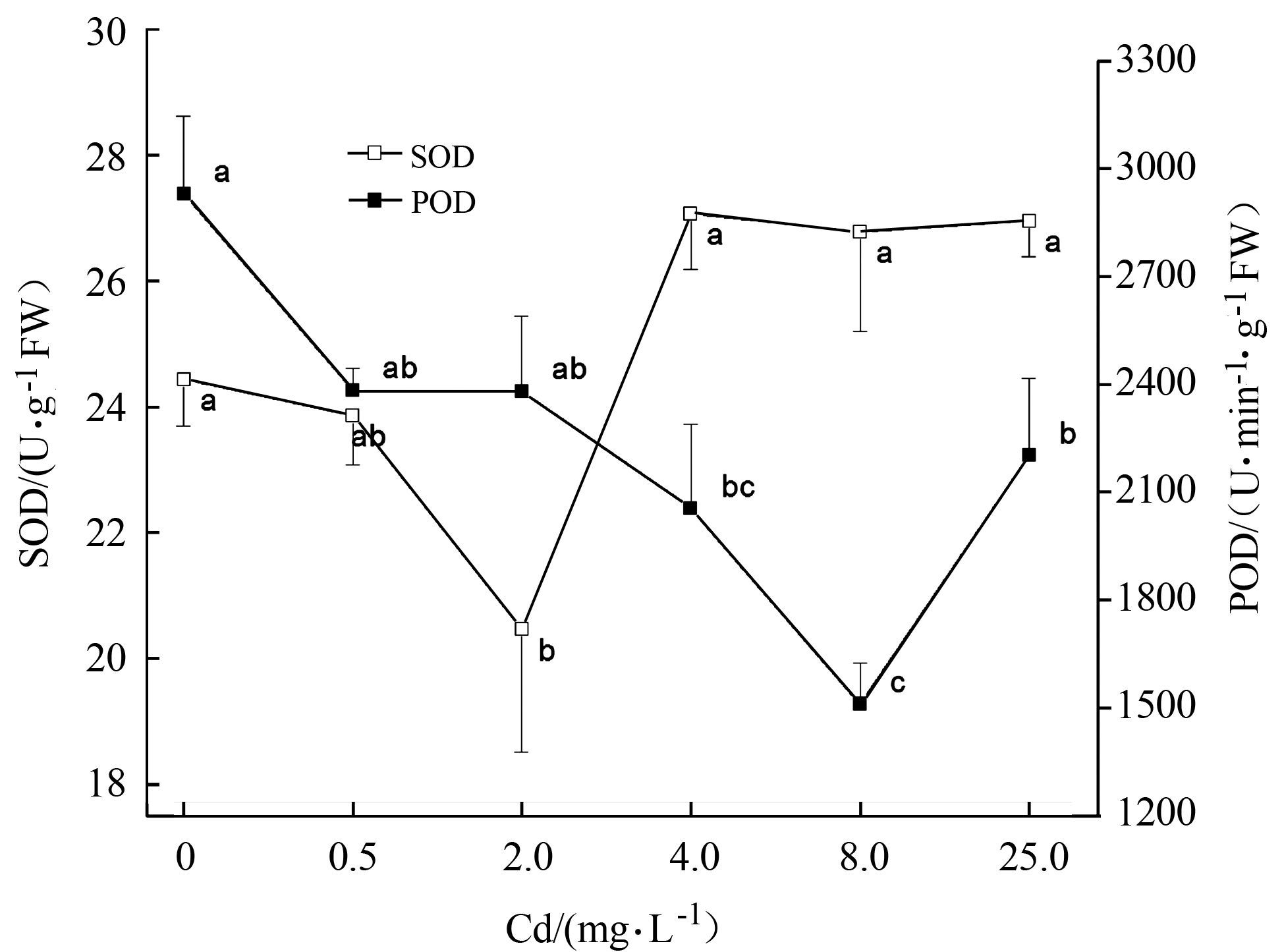
|
图 2 镉处理对水仙根系抗氧化酶活性影响 Figure 2 SOD and POD activities in roots of daffodil plants exposed to exogenous Cd |
镉处理显著影响根系中POD活性(P<0.05),随着营养液中镉处理浓度的增加,根中POD活性呈现先下降后上升的趋势(图 2)。在Cd 8处理下POD活性最低,与对照处理相比下降48.5%;Cd 4和Cd 25处理下POD活性分别比对照下降29.9和24.9%。
2.5 镉对水仙根系NPT和GSH含量影响由图 3可知,与对照处理相比,镉浓度0.5、4 mg·L-1处理对根系GSH含量影响不显著,而Cd 8和Cd 25处理浓度显著增加其含量,分别比对照高78.1和116.2%。较高浓度镉胁迫没有显著影响根系非蛋白巯基NPT含量,只有低浓度镉处理(Cd 0.5)显著降低了根系NPT含量,其低于对照9.7%。

|
图 3 镉处理对水仙根系巯基含量影响 Figure 3 Accumulation of thiolin roots of daffodil plants exposed to exogenous Cd |
植株处于正常生长环境中,活性氧和过氧化氢的积累控制于各种酶和化学的清除代谢过程中,逆境胁迫使得抗氧化系统与活性氧之间平衡被打破,诱发活性氧增加而导致氧化胁迫[11]。丙二醛是细胞膜脂过氧化胁迫的重要产物,其含量高低代表植株遭受环境胁迫的强弱。过氧化氢是由于活性氧在氧化酶(主要是SOD酶)催化作用下形成,再通过多酚氧化酶、过氧化氢酶(CAT)或过氧化物酶(POD)催化氧化还原降解为水和氧气。许多研究报道了镉胁迫导致植物体内活性氧(或者过氧化氢)大量产生和积累[7]。本研究中低浓度镉处理已导致根系丙二醛含量显著增加,丙二醛含量随镉胁迫浓度的增加而增加,4~25 mg·L-1 镉处理浓度亦诱导水仙根系过氧化氢含量显著增加,表明低浓度镉胁迫已对水仙造成氧化胁迫,根系氧化胁迫随着镉处理浓度增加而加重。不同植物丙二醛含量对镉胁迫响应不同,有些镉耐性较强的植物膜脂稳定性较高,比如滇苦菜和东南景天膜在镉处理浓度较低时两种植物丙二醛含量都没有显著变化[12-13]。
生物抗氧化性系统包括具有高度还原性的非酶成分和抗氧化酶类,植物抗氧化系统活性的增加与植物抗逆性密切相关。一些研究显示低浓度重金属胁迫能够增加氧化酶活性,高浓度重金属胁迫显著降低酶活性。超氧化物歧化酶是体内抗氧化系统中关键酶类,本研究中镉对水仙根系SOD酶活性影响不高,只有2 mg·L-1 Cd显著抑制酶活性,其他镉处理没有显著影响SOD活性。不同植物镉耐性和防御机制不同,SOD酶活性对镉处理响应也不同,在一些植物中高浓度镉胁迫可能导致活性氧的累积,从而激活更多SOD,或者由于镉处理增强编码SOD基因的表达,比如玉米、滇苦菜、芦苇SOD活性随着镉处理浓度的增加而增加[7, 12, 14]。而在另一些植物中随着镉处理浓度的增加SOD活性亦降低,可能是由于产生的过氧化氢抑制SOD活性,或者镉产生毒害作用抑制SOD酶基因的转录和表达[15]。高阳等研究镉胁迫时间对抗氧化酶活性的影响,结果显示时间明显影响烟草愈伤组织SOD酶活性,本研究中水仙根系SOD酶活性对镉响应可能与胁迫时间有关,是镉对根系过氧化氢含量和SOD酶生成过程影响的最终结果,其机制有待进一步研究[16]。
过氧化物酶是植物体内活性较高的适应性酶,广泛存在于植物体内不同组织,可消除SOD歧化反应的产物过氧化氢。目前研究显示POD对植物适应性具有双重作用,一方面POD在逆境初期表现为保护效应,能够及时分解过氧化氢而减轻活性氧对植物的危害;另一方面,POD在逆境后期表达参与活性氧生成,促进叶绿素降解,表现为伤害效应。一些研究表明由于底物浓度的增加,在一定低浓度范围内重金属胁迫使得POD活性随着重金属胁迫浓度的增加而增加,高浓度胁迫下,由于对POD酶的伤害,而使POD活性降低[17]。本研究结果与镉对滇苦菜根部POD活性影响相似,在一定范围镉处理浓度下,对照镉处理浓度的增加,水仙根部POD活性下降[12]。许多研究显示逆境初期所产生的大量活性氧诱导抗氧化酶的表达和活性增加,但随着胁迫进行,胁迫超过自身忍耐程度,导致基因表达量和酶活性下降[18]。本研究是在镉处理一个月后进行,结果显示POD活性随镉胁迫剂量的升高而逐渐下降,清除过氧化氢的能力逐渐降低,导致体内过氧化氢含量升高,说明水仙镉耐性随镉胁迫浓度的升高而逐渐下降;而高浓度镉胁迫(Cd 25)下根系POD活性升高,推测升高的POD活性表达参与活性氧生成,使得植物氧化胁迫增加。
巯基对镉具有很强的亲和力,GSH和PC等非蛋白巯基(NPT)物质在植物耐镉性中起到重要作用[19]。一些研究显示镉胁迫导致植物体内大量合成非蛋白巯基化合物以降低镉毒害[20-21],而本研究中较高浓度镉胁迫没有显著影响根系总巯基含量,但高浓度镉处理显著增加了GSH含量。有些研究也表明重金属没有影响植物体内非蛋白巯基总量,而GSH在重金属解毒中更为重要[20, 22]。谷胱甘肽GSH是最丰富的低分子硫醇,在细胞分化和发育中扮演了重要角色,是较为丰富的非酶类抗氧化物质,也是合成植物络合素PCs的前体和多种抗氧化酶底物,而且GSH具有-SH能与重金属络合形成硫肽复合物,降低重金属毒性,所以GSH含量的变化对植物耐重金属性起着重要作用。有些研究也表明植物体内过量表达GSH合成酶基因能够提高植物抗逆性[23]。本研究中8~25 mg·L-1 镉处理显著增加了GSH含量,表明水仙根系在高浓度镉胁迫下通过合成GSH提高自身抗逆性,这与苜蓿叶片抗氧化系统对镉胁迫影响类似,苜蓿叶片SOD活性在高浓度镉胁迫下最低,而GSH含量在高浓度镉胁迫下达到高峰[24]。
水仙花根系膜稳定性较弱,低浓度镉处理已导致水仙花根系遭受氧化胁迫,使得MDA含量显著增加;水仙花根系抗氧化酶活性对镉的响应较弱,没有显示随着镉处理浓度增加而增加的浓度效应,反而POD活性被镉处理抑制;高浓度镉胁迫显著增加水仙花根系非酶类抗氧化物质GSH 含量。
| [1] |
吴菁华, 张志忠, 吕柳新.
中国水仙3个特异种质的分子细胞遗传学分析[J]. 园艺学报 , 2011, 38 (4) : 740–746.
( 0) 0)
|
| [2] |
陈林姣, 缪颖, 陈德海, 等.
中国水仙种质资源的遗传多样性分析[J]. 厦门大学学报:自然科学版 , 2002, 41 (6) : 810–814.
( 0) 0)
|
| [3] |
KANDZIORA-CIUPA M, CIEPAL R, NADG RSKA-SOCHA A, et al.
A comparative study of heavy metal accumulationand antioxidant responses in Vaccinium myrtillus L.leaves in polluted and non-polluted areas[J]. Environ Sci Pollut Res , 2013, 20 : 4920–4932.
DOI:10.1007/s11356-012-1461-4 ( 0) 0)
|
| [4] |
YADAV S K.
Heavy metals toxicity in plants:An overview on the role of glutathione and phytochelatins in heavy metal stress tolerance of plants[J]. South African Journal of Botany , 2010, 76 : 167–179.
DOI:10.1016/j.sajb.2009.10.007 ( 0) 0)
|
| [5] |
DUBEY S, SHRI M, Misra P, et al.
Heavy metals induce oxidative stress and genome-widemodulation in transcriptome of rice root[J]. Funct Integr Genomics , 2014, 14 : 401–417.
DOI:10.1007/s10142-014-0361-8 ( 0) 0)
|
| [6] |
刘俊祥, 孙振元, 巨关升, 等.
结缕草对重金属镉的生理响应[J]. 生态学报 , 2011, 31 (20) : 6149–6156.
( 0) 0)
|
| [7] |
赵士诚, 孙静文, 马有志, 等.
镉对玉米幼苗活性氧代谢、超氧化物歧化酶和过氧化氢酶活性及其基因表达的影响[J]. 中国农业科学 , 2008, 41 (10) : 3025–3032.
( 0) 0)
|
| [8] |
XIONG Y H, YANG X E, YE Z Q, et al.
Characteristicsof cadmiumup-take and accumulation by two cont rasting ecotypes of Sedum alfredii Hance[J]. J Environ Sci Health , 2004, 39 : 2925–2940.
DOI:10.1081/LESA-200034269 ( 0) 0)
|
| [9] |
RAMA DS, PRASAD MNV.
Copper toxicity in Ceratophyllum demersum L.(Coontail),a free floating macrophyte:Response of antioxidant enzymes and antioxidants[J]. Plant Science , 1998, 138 (2) : 157–165.
DOI:10.1016/S0168-9452(98)00161-7 ( 0) 0)
|
| [10] |
高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006 : 223 -224.
( 0) 0)
|
| [11] |
阮亚男, 何兴元, 陈玮, 等.
臭氧浓度升高对植物抗氧化系统的影响[J]. 生态学杂志 , 2008, 27 (5) : 829–834.
( 0) 0)
|
| [12] |
汤叶涛, 关丽捷, 仇荣亮, 等.
镉对超富集植物滇苦菜抗氧化系统的影响[J]. 生态学报 , 2010, 30 (2) : 0324–0332.
( 0) 0)
|
| [13] |
JIN XF, YANG X E, ISLAM E, et al.
Effects of cadmium on ultrastructure and antioxidative defense system in hyperaccumulator and non-hyperaccumulator ecotypes of Sedum alfredii Hance[J]. Journal of Hazardous Materials , 2008, 156 : 387–397.
DOI:10.1016/j.jhazmat.2007.12.064 ( 0) 0)
|
| [14] |
IANNELLI M A, PIETRINI F, FIORE L, et al.
Antioxidant response to cadmium in Phragmites australis plants[J]. Plant Physiology and Biochemistry , 2002, 40 : 977–982.
DOI:10.1016/S0981-9428(02)01455-9 ( 0) 0)
|
| [15] |
SOMKA A, LIBIK-KONIECZNY M, KUTA E, et al.
Metalliferous and non-metalliferous populationsof Viola tricolor represent similar mode of antioxidative response[J]. Journal of Plant Physiology , 2008, 165 : 1610–1619.
DOI:10.1016/j.jplph.2007.11.004 ( 0) 0)
|
| [16] |
高阳, 娄虹, 李淑媛, 等.
镉胁迫对烟草愈伤组织抗氧化系统的影响[J]. 生态学杂志 , 2014, 33 (5) : 1217–1223.
( 0) 0)
|
| [17] |
许丽璇, 王春凤, 王慧云, 等.
桐花树抗重金属铅胁迫的谷胱甘肽及抗氧化酶作用[J]. 中国农学通报 , 2010, 26 (15) : 215–220.
( 0) 0)
|
| [18] |
刘家忠, 龚明.
植物抗氧化系统研究进展[J]. 云南师范大学学报:自然科学版 , 1999, 19 (6) : 1–11.
( 0) 0)
|
| [19] |
( 0) 0)
|
| [20] |
原海燕, 郭智, 佟海英, 等.
Pb胁迫下外源GSH对马蔺体内Pb积累和非蛋白巯基化合物含量的影响[J]. 水土保持学报 , 2013, 27 (4) : 212–216.
( 0) 0)
|
| [21] |
原海燕, 黄钢, 佟海英, 等.
Cd胁迫下马蔺根和叶中非蛋白巯基肽含量的变化[J]. 生态环境学报 , 2013, 22 (7) : 1214–1219.
( 0) 0)
|
| [22] |
GUPTA D K, HUANG H G, YANG X E, et al.
The detoxification of lead in sedum alfredii H.is not related to phytochelatins but the glutathione[J]. Journal of hazardous materials , 2010, 177 : 437–444.
DOI:10.1016/j.jhazmat.2009.12.052 ( 0) 0)
|
| [23] |
贾翠翠, 季静, 王罡, 等.
过表达谷胱甘肽合成酶基因增强烟草对镉的耐受性[J]. 中国生物工程杂志 , 2014, 34 (10) : 79–86.
( 0) 0)
|
| [24] |
吴旭红, 付本丽.
不同浓度镉对苜蓿生长及抗氧化系统的影响[J]. 黑龙江大学自然科学学报 , 2005, 22 (3) : 363–365.
( 0) 0)
|
 2016, Vol. 31
2016, Vol. 31