太子参Pseudostellaria heterophylla(Miq.)Pax et Hoffm为石竹科异叶假繁缕属植物,又名孩儿参、童参等,是常用中药材之一,以干燥块根提供药用[1]。福建省柘荣县被誉为全国太子参之乡,全县90%以上农民种植太子参[2]。长期以来,太子参均以块根进行无性繁殖,体内浸染并积累多种病毒,严重影响了太子参的产量和质量。
太子参病毒病又称花叶病,是太子参产区发生普遍、危害严重的病害之一,严重影响产量和品质[3]。染病叶常表现为花叶、斑驳花叶、皱缩、扭曲、畸形、叶缘卷曲、叶质脆硬,病株矮小、块根小且根数明显减少,严重者整株死亡[4]。目前已知危害太子参的病原有4种[5],分别为烟草花叶病毒(Tobacco mosaic virus,TMV),芜菁花叶病毒(Turnip mosaic virus,TuMV),黄瓜花叶病毒(Cucumber mosaic virus,CMV)和蚕豆萎蔫病毒(Broad bean wili virus,BBMV),其中以芜菁花叶病毒广泛分布于全国太子参各产区[6],是为害太子参的主要病毒病原。
近年来,太子参的相关研究集中在栽培技术和药材质量方面,而对太子参中各种病毒的检测研究较少。本研究针对高度保守的芜菁花叶病毒CP基因,采用RT-PCR技术,对太子参病株的各个部位进行了芜菁花叶病毒检测,以期为太子参的病毒防治和脱毒种苗制备提供科学依据。
1 材料和方法 1.1 材料与试剂材料及采集保存:太子参病株样品来源于福建省宁德市柘荣县。采集新鲜植物组织,迅速移入液氮保存,用于总RNA提取。
试剂:总RNA提取纯化试剂盒E.Z.N.A. Plant RNA Kit(R6827-01)购于OMEGA公司;反转录试剂盒TransScript® One-Step gDNA Removal and cDNA Synthesis SuperMix购于北京全式金生物技术(TransGen Biotech)有限公司;rTaq酶购于Takara宝生物工程有限公司;100 bp DNA Marker购于广州东盛生物科技有限公司。
1.2 试验方法 1.2.1 引物设计根据GenBank中已登录的TuMV CP基因的核苷酸序列(登录号为AJ000690.1)设计TuMV引物,引物由生工生物工程(上海)股份有限公司合成。上游引物F:5′-ACCAAGACCGACCATACA-3′;下游引物R:5′-CCATAAGCGAGAATACTAACG-3′。
1.2.2 病毒RNA的提取植物总RNA提取参照OMEGA公司的E.Z.N.A.TM Plant RNA Kit(R6827-01)提取试剂盒说明书提取,分别用eppendorf BioPhotometer plus微量核酸蛋白分析仪和质量分数为1.5 %的琼脂糖凝胶电泳检测浓度和纯度,并利用TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix反转录试剂盒去除DNA并反转成cDNA,于-20℃保存备用。
1.2.3 RT-PCR检测病毒PCR反应体系50 mm3:10×PCR Buffer(含Mg2+)5 mm3,dNTP(2.5 mmol·dm-3)4 mm3,正、反向引物(10 μmol·dm-3)各2 mm3,Taq DNA Polymerase(5 U·mm-3)0.5 mm3,cDNA模板量约2 mm3,补足双蒸水至总体积为50 mm3。PCR反应程序:94℃ 预变性5 min;94℃ 变性30 s,55℃ 退火30 s,72℃ 延伸30 s,共40个循环;72℃ 延伸10 min;4℃ 停止。扩增得到的PCR产物经1.5 %琼脂糖凝胶电泳分析,目的条带送测序,测序结果进行比对分析。
1.2.4 序列及分析PCR产物直接测序,方法简便可靠。将扩增得到的PCR产物直接送铂尚生物技术(上海)有限公司测序,测序结果在NCBI上进行Blast比对分析。
2 结果与分析 2.1 总RNA提取紫外分光光度计检测所提取的太子参病叶总RNA OD260/OD280比值在1.8 ~ 2.0范围内。琼脂糖凝胶电泳表明,所提取的RNA主带清晰,没有明显降解,符合试验要求(图 1)。
|
图 1 太子参总RNA Figure 1 Total RNA of P.heterophylla 注:M为100 bp Marker;1为叶片1;2为叶片2;3为叶片3。 |
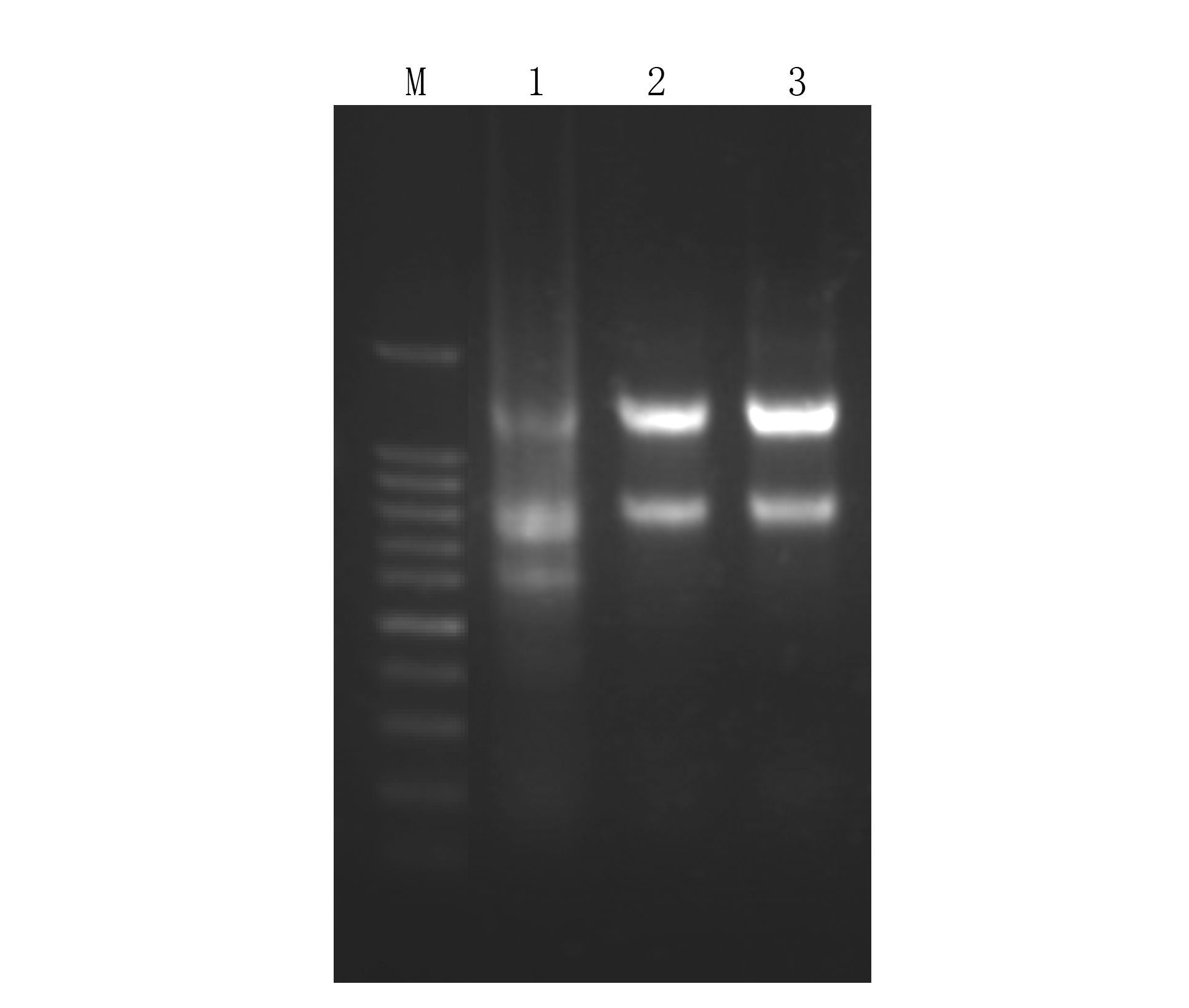
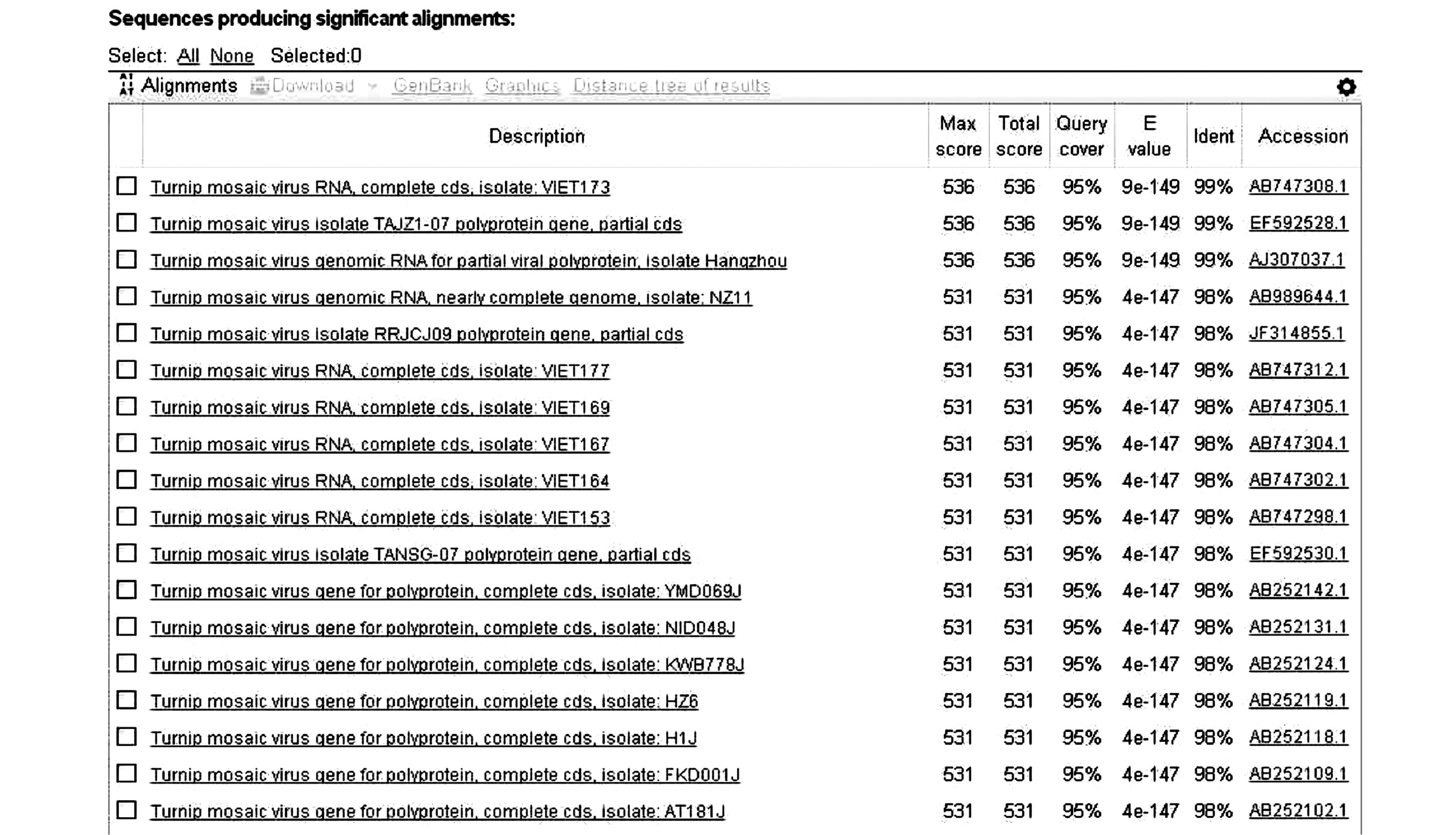
太子参cDNA中扩增得到目的CP基因序列电泳图(图 2)。对扩增得到的目的片段进行测序分析(图 3),经过NCBI Blast分析,扩增得到的序列与烟草花叶病毒的CP基因片段相似度高(图 4),结果表明目的片段为芜菁花叶病毒的CP基因片段。

|
图 2 TuMV检测结果 Figure 2 Detection of TuMV 注:M为100 bp Marker;1为叶片1;2为叶片2;3为叶片3。 |
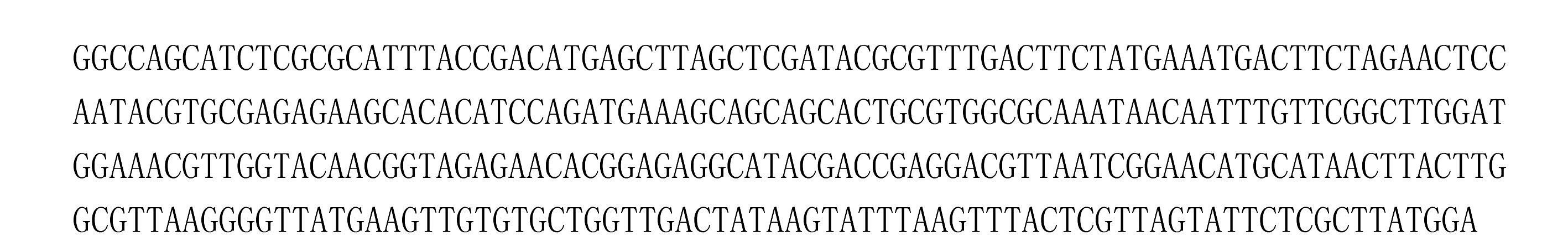
|
图 3 太子参中芜菁花叶病毒CP基因序列片段 Figure 3 Fragment of TuMV CP gene on diseased P. heterophylla |
|
图 4 太子参中芜菁花叶病毒cp基因片段序列Blast结果 Figure 4 Blast analysis of TuMV CP gene on dieased P. heterophylla |
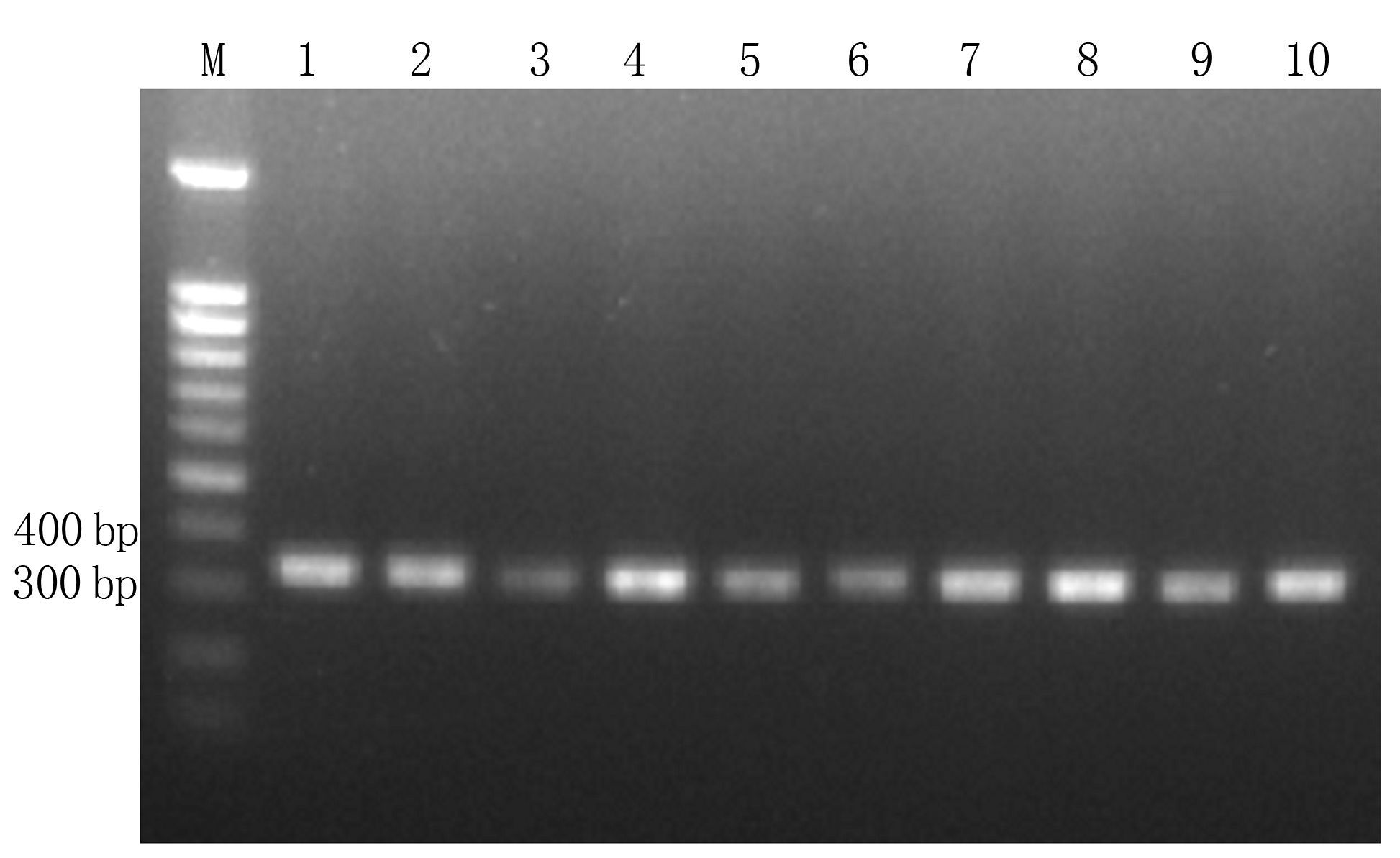
按照本试验建立的RT-PCR方法对太子参病株的不同组织分布进行检测,选取带花的太子参植株进行检测,选取部位包括叶肉、叶脉、花、茎上部、茎中部、茎下部、根上部、根中部、根下部和须根。通过RT-PCR技术检测,结果(图 5)显示感染芜菁花叶病毒的太子参在各部位均有分布。
|
图 5 不同部位TuMV检测结果 Figure 5 Detection of TuMV at different locations 注:M为100 bp Marker;1为叶肉;2为叶脉;3为花;4为茎上部;5为茎中部;6为茎下部;7为根上部;8为根中部;9为根下部;10为须根。 |
本试验建立太子参中芜菁花叶病毒的RT-PCR检测方法,同时应用该方法对太子参病株不同部位的芜菁花叶病毒进行检测分析。
相对于传统的病毒分离电镜检查、ELISA、核酸杂交和基因芯片等其他病毒检测方法,RT-PCR方法具有灵敏度高、操作简便、特异性较高和成本较低等优点[7-8],能够满足了大规模病毒样品的分析。
福建省柘荣县太子参病毒种类多样,除芜菁花叶病毒,本课题组还在不同的样品中检测到蚕豆萎蔫病毒、烟草花叶病毒。多种病毒的作用造成了太子参病毒病危害严重,造成太子参减产和农民减收,所以本文建立的太子参的病毒检测技术,进而进行多种病毒的多重检测技术研发,为太子参病毒防治,开发太子参脱毒种苗,提高太子参的产量和质量提供技术保障。
| [1] |
肖培根, 李大鹏, 杨世林. 新编中药志:第一卷[M]. 北京: 化学工业出版社, 2002 : 191 -193.
( 0) 0)
|
| [2] |
袁小坦, 袁家雄.
柘荣县太子参产业发展现状与对策[J]. 福建农业科技 , 2014 (7) : 68–70.
( 0) 0)
|
| [3] |
吴朝峰, 林彦铨.
药用植物太子参的研究进展[J]. 福建农林大学学报:自然科学版 , 2005, 33 (4) : 426–430.
( 0) 0)
|
| [4] |
刘清琪, 等.
太子参花叶病病原及其防治的初步研究[J]. 中药材科技 , 1953 (2) : 11.
( 0) 0)
|
| [5] |
宋荣浩, 濮祖芹.
太子参病毒病病原鉴定[J]. 上海农业学报 , 1991, 7 (2) : 80–85.
( 0) 0)
|
| [6] |
朱艳, 周小华, 秦民坚.
太子参病毒病及其脱病毒研究进展[J]. 中国野生植物资源 , 2005, 24 (2) : 31–32.
( 0) 0)
|
| [7] |
王新, 莫笑晗, 林良斌.
分子生物学技术在植物病毒检测中的应用[J]. 安徽农业科学 , 2009, 37 (28) : 13498–13500.
( 0) 0)
|
| [8] |
周利飞, 刘映红, 孙现超, 等.
烟草芜菁花叶病毒的ELISA和RT-PCR快速检测技术研究[J]. 西南农业学报 , 2007, 20 (4) : 758–761.
( 0) 0)
|
 2016, Vol. 31
2016, Vol. 31
