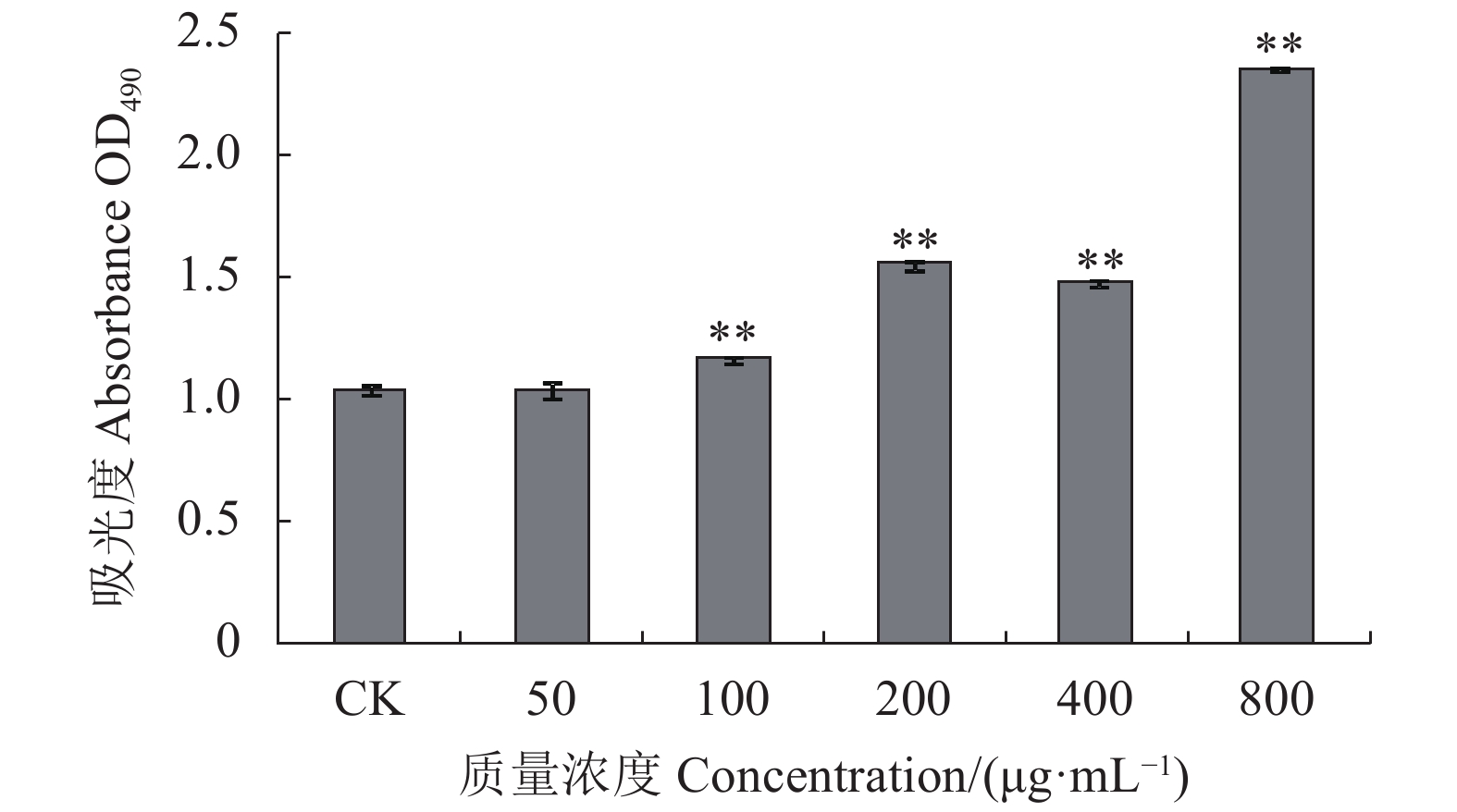
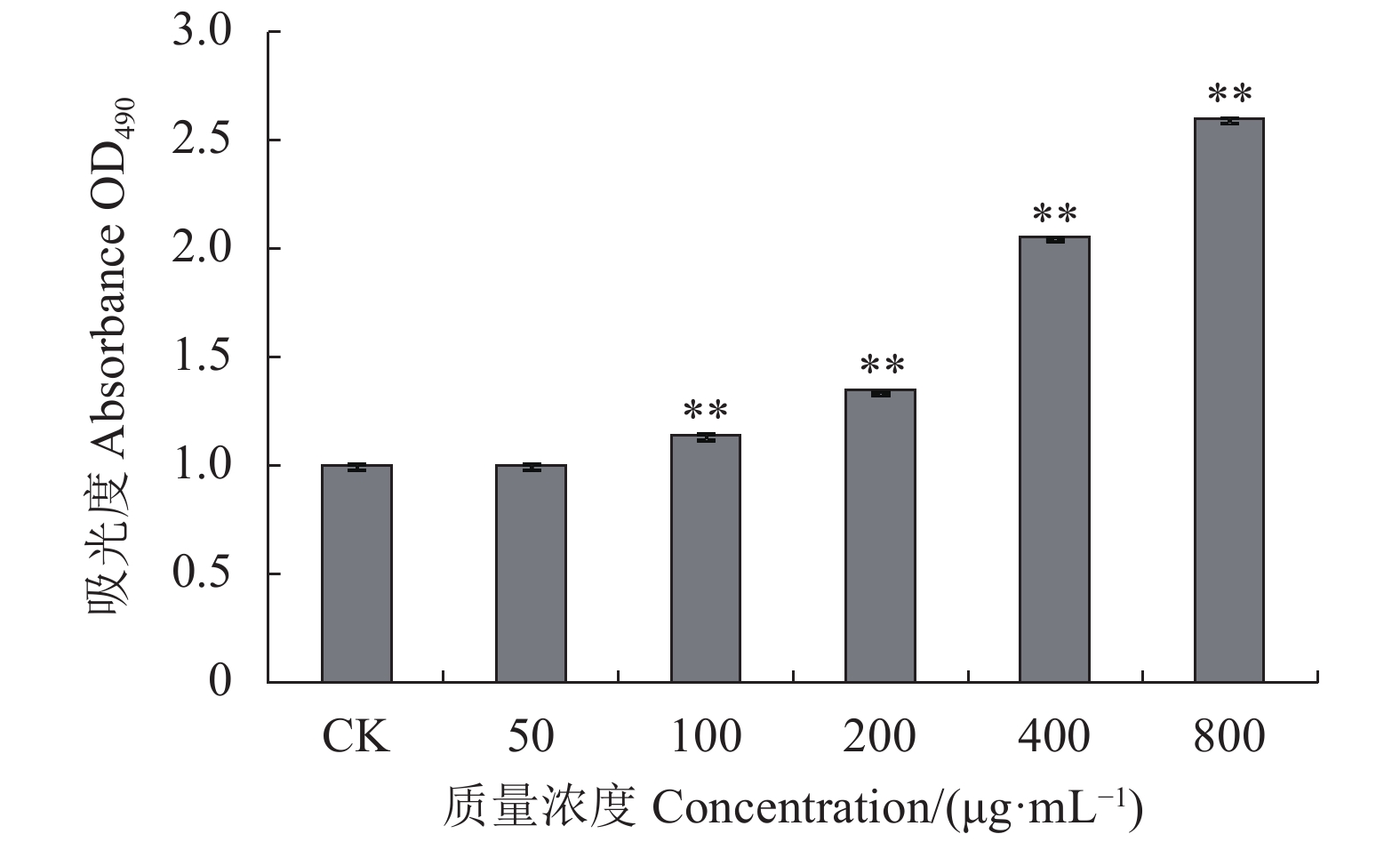
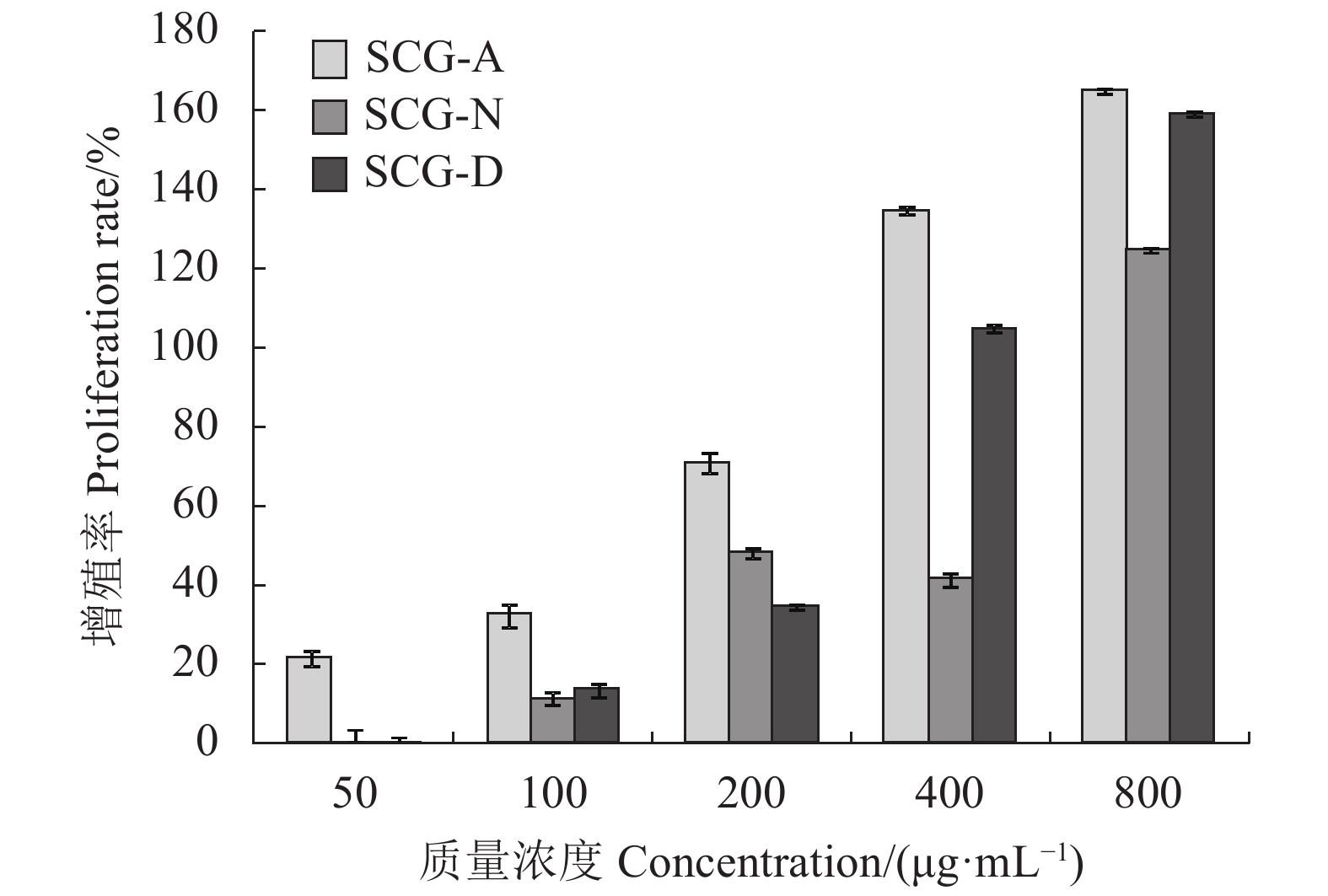
|
[1]
|
KIMURA T. Natural products and biological activity of the pharmacologically active cauliflower mushroom Sparassis crispa [J]. BioMed Research Intermational, 2013, 8(3): 501−508.
|
|
[2]
|
CHANDRASEKARAN G, OH D S, SHIN H J. Properties and potential applications of the culinary-medicinal cauliflower mushroom, Sparassis crispa (Wulf.: Fr.) (Aphyllophoromycetideae): a review [J]. International Journal of Medicinal Mushrooms, 2011, 13(2): 177−183. doi: 10.1615/IntJMedMushr.v13.i2.100
|
|
[3]
|
KIM H S, KIM J Y, RYU H S, et al. Induction of dendritic cell maturation by β-glucan isolated from Sparassis crispa [J]. International Immunopharmacology, 2010, 10(10): 1284−1294. doi: 10.1016/j.intimp.2010.07.012
|
|
[4]
|
KIM H H, LEE S, SINGH T S, et al. Sparassis crispa Suppresses mast cell-mediated allergic inflammation: Role of calcium, mitogen-activated protein kinase and nuclear factor-κB [J]. Intermational Journal of Molecular Medicine, 2012, 30(2): 344−350. doi: 10.3892/ijmm.2012.1000
|
|
[5]
|
白晨, 宋文荣, 杨剑飞, 等. 绣球菌子实体干燥条件与多糖保留率相关性研究 [J]. 食品科学, 2012, 33(20):119−122.BAI C, SONG W R, YANG J F, et al. Effect of Drying Methods on Retention Rate of Polysaccharides in Sparassia crispa Fruit Bodies [J]. Food Science, 2012, 33(20): 119−122.(in Chinese)
|
|
[6]
|
朱美静, 童群义. 猴头多糖脱蛋白方法的研究 [J]. 河南工业大学学报(自然科学版), 2005, 26(4):25−27. doi: 10.3969/j.issn.1673-2383.2005.04.007ZHU M J, TONG Q Y. Study on Removal of Proten from Hericium erinaceus Polysaccharides [J]. Journal of Henan University of Technology (Natural Science Edition), 2005, 26(4): 25−27.(in Chinese) doi: 10.3969/j.issn.1673-2383.2005.04.007
|
|
[7]
|
金丽琴, 薛胜霞, 吕建新, 等. 牛膝多糖衍生物对小鼠脾淋巴细胞增殖及诱生IL-2和TNF-α的影响 [J]. 中国生化药物杂志, 2008, 29(5):312−314.JIN L Q, XUE S X, LU J X, et al. Effect of derivatives of Achyranthes bidentata polysaccharides on lymphocyte proliferation and induction of IL-2 and TNF- [J]. Chinese Journal of Biochemical Pharmaceutics, 2008, 29(5): 312−314.(in Chinese)
|
|
[8]
|
JAMAS S, EASSON D, STROFF GRO, et al. Method for producing soluble glucan: United States Patent, 5633369[P]. 1997.
|
|
[9]
|
TZIANABOS A O. Polysaccharide immunomodulators as therapeutic agents: structural aspects and biologic function [J]. Clinical Microbiology Reviews, 2000, 13(4): 523−533. doi: 10.1128/CMR.13.4.523
|
|
[10]
|
张迪, 王宏雨, 林衍铨. 不同干制方法对广叶绣球菌多糖提取率和分子量分布的影响 [J]. 中国食用菌, 2017, 36(3):54−56.ZHANG D, WANG H Y, LIN Y Q. Effects of Different Drying Methods on Extraction Rate and Molecular Weight Distribution of Polysaccharides from Sparassis latifolia [J]. Edible Fungi of China, 2017, 36(3): 54−56.(in Chinese)
|
|
[11]
|
钱正明, 李文庆, 孙敏甜, 等. 冬虫夏草化学成分分析 [J]. 菌物学报, 2016, 35(4):476−490.QIAN Z M, LI W Q, SUN M T, et al. Analysis of chemical compounds in Chinese cordyceps [J]. Mycosystema, 2016, 35(4): 476−490.(in Chinese)
|
|
[12]
|
马晓丽, 孟磊, 孙莲, 等. HPLC分析大蒜多糖中的单糖 [J]. 中国现代应用药学杂志, 2009, 26(7):585−587.MA X L, MENG L, SUN L, et al. Determination of Monosaccharide Compositions and Contents in Polysaccharide of Garlic by HPLC [J]. Chinese Journal of Modern Applied Pharmacy, 2009, 26(7): 585−587.(in Chinese)
|
|
[13]
|
李平厉. 硫酸化可德兰多糖的制备、体外免疫调节、抗乙肝病毒感染活性及体内用作乙肝疫苗[D]. 济南: 山东大学, 2014.LI P L. Studies on the preparation, in vitro immunoregulatory andanti-hepatitis B virus infection activities and invivo action as a hepatitis B vaccine adjuvant of curdlan sulfate[D]. Jinan: Shandong University, 2014. (in Chinese)
|
|
[14]
|
陈晓兰, 杨海峰, 瞿静雯, 等. 不同桑叶提取物对小鼠脾脏淋巴细胞增殖能力的影响 [J]. 中国畜牧兽医, 2017, 44(12):3598−3604.CHEN X L, YANG H F, QU J W, et al. Effect of Different Mulberry Leaf Extracts on Spleen Lymphocyte Proliferation in Mice [J]. China Animal Husbandry & Veterinary Medicine, 2017, 44(12): 3598−3604.(in Chinese)
|
|
[15]
|
RUI TADA, TOSHIE HARADA, NORIKO NAGI-MIUR, et al. NMR characterization of the structure of a b-(1, 3)-D-glucan isolate from cultured fruit bodies of Sparassis crispa [J]. Carbohydrate Research, 2007, 342: 2611−2618. doi: 10.1016/j.carres.2007.08.016
|






 下载:
下载: