Artificial RNA Interference on Frankliniella occidentalis
-
摘要:
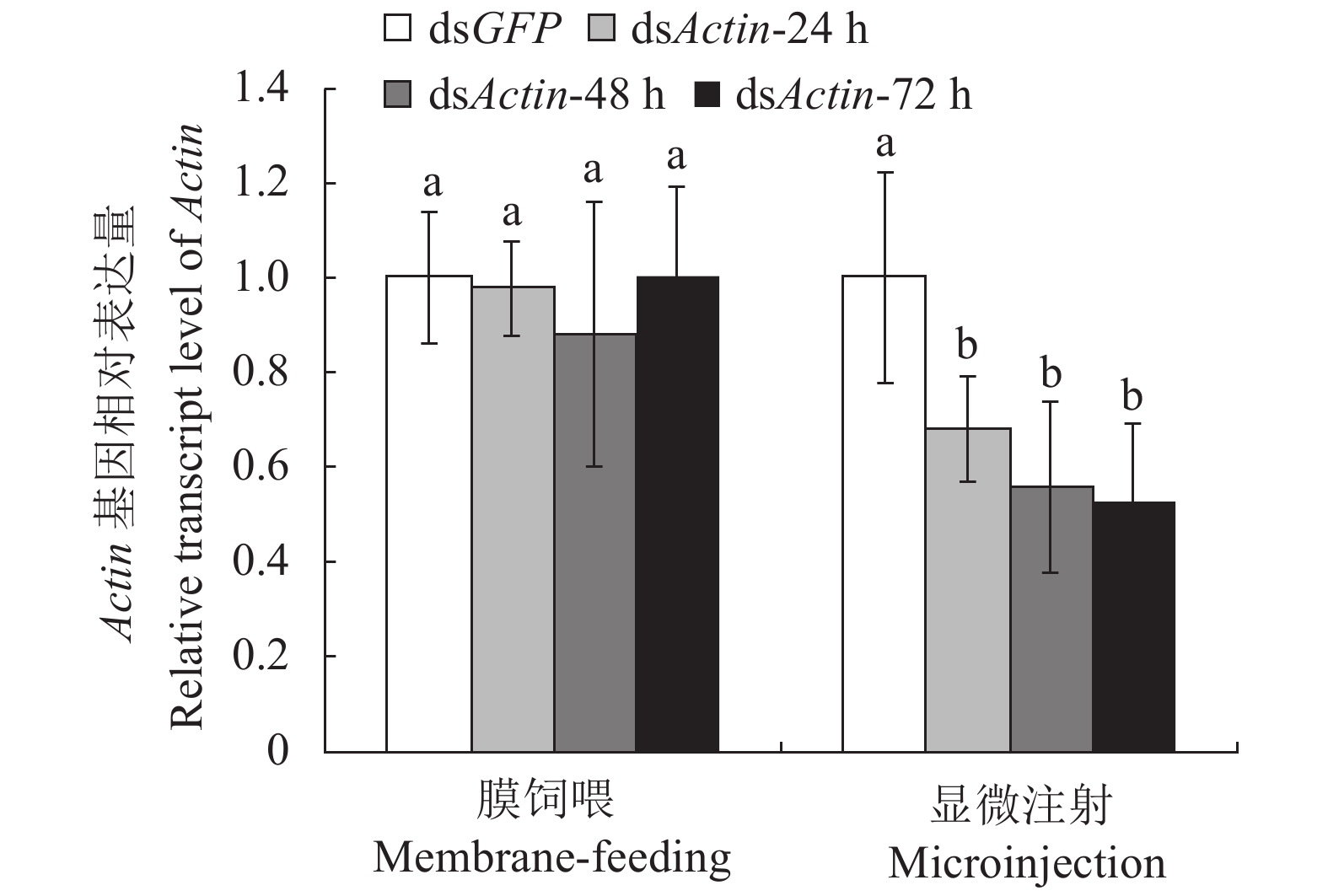
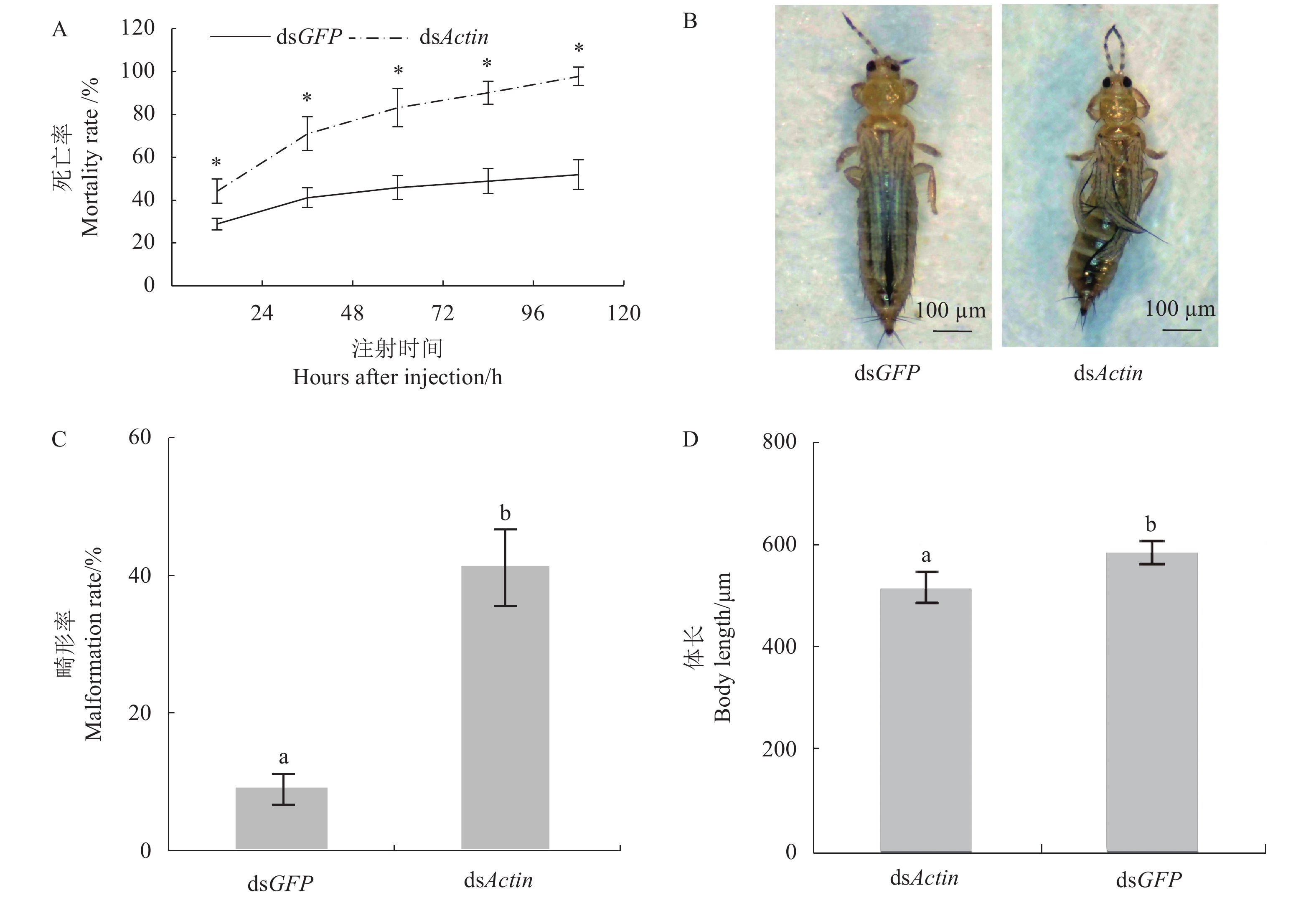
目的 西花蓟马Frankliniella occidentalis (Pergande)是一种重要的外来入侵害虫,其繁殖能力强、寄主范围广、抗药性强,给我国蔬菜、花卉等经济作物造成了严重危害。本研究旨在评估膜饲喂和显微注射dsActin对西花蓟马Actin基因的沉默效率,以期为蓟马类等小型昆虫基因功能的研究提供方法和依据。 方法 通过膜饲喂和显微注射的方法将体外合成的dsActin导入西花蓟马二龄若虫体内,用RT-qPCR方法检测Actin基因的mRNA表达;通过单头饲养方法观察统计西花蓟马成虫体长、成虫翅膀或胸腹部畸形率及死亡率。 结果 dsActin膜饲喂后24 、48、72 h,Actin基因的相对表达量分别为对照组的97%、91%和98%;通过显微注射将dsActin注入西花蓟马体腔,在注射后24、48、72 h,Actin基因的表达量分别为对照组的68%、56%和53%。注射dsActin的西花蓟马在第24~120 h 死亡率为44%~98%,显著高于dsGFP对照组;此外,dsActin组个体体长仅为dsGFP对照组的90%,且翅膀或胸腹部出现畸形率为41%。 结论 显微注射dsActin能显著沉默西花蓟马Actin基因mRNA水平的表达,并引起西花蓟马个体不正常发育和死亡,从而建立蓟马类小型昆虫RNAi体系。 Abstract:Objective Application of dsActin to control the proliferating, multiple-hosting, insecticide-resistant invasive western flower thrips on vegetables and ornamental crops in China was investigated. Method Synthetic dsActin or dsGFP (as control) was introduced into the 2nd-instar nymphs of Frankliniella occidentalis (Pergande) by either membrane-feeding or microinjection. The treated thrips were collected for mRNA expression detection by RT-qPCR at 24, 48 and 72 h after the treatment. Effects of 0.5 μg·μL−1 dsRNA on the body length, wing or thorax malformation, and mortality of the insects were monitored in an individual culture experiment conducted in the laboratory. Result The relative expression of Actin mRNA in the thrips was similar to that of control 24, 48 and 72 h after membrane-feeding. But the expressions in the injection group decreased to 68% in 24 h, 56% in 48 h, and 53% in 72 h. Significantly higher mortality rate (44%-98% in 24-120 h), shorter body length (90% of control), and higher bodily deformation rate (41%) were observed in the dsRNA-treated thrips than control. Conclusion The Actin mRNA expression in F. occidentalis was significantly suppressed by dsActin injection at the test level to induce malformations or death in the insects. It suggested that an in vivo RNA interference method was made available for studying the gene functions and control of thrips. -
Key words:
- Frankliniella occidentalis /
- RNA interference /
- membrane-feeding /
- microinjection
-
表 1 引物信息
Table 1. Primers applied
引物名称
Primer name序列(5′-3′)
Sequence (5′-3′)Actin/F ATGTGTGACGACGATGTTGC Actin/R TTAGAAGCACTTGCGGTGGACG T7Actin/F TAATACGACTCACTATAGGGTTCGTGGGCATGGAATC
TTGCGGTATT7Actin/R TAATACGACTCACTATAGGGCGGACTCGTCGTACTCG
TCCTTGGAGAT7GFP/F TAATACGACTCACTATAGGGCGAGGAGCTGTTCACC
GGT7GFP/R TAATACGACTCACTATAGGGTCCTCGATGTTGTGGCGG q18S/F TTTTATGGTGGTGTTGTTGTGG q18S/R CAAGGGCTTTGGGTAATGG qActin /F TGGTCGGTATGGGACAGAAGGA qActin/R TCGGTGAGCAGGACAGGGTG -
[1] MAO Y B, CAI W J, WANG J W, et al. Silencing a cotton bollworm P450 monooxygenase gene by plant-mediated RNAi impairs larval tolerance of gossypol [J]. Nature Biotechnology, 2007, 25(11): 1307−1313. doi: 10.1038/nbt1352 [2] BAUM J A, BOGAERT T, CLINTON W, et al. Control of coleopteran insect pests through RNA interference [J]. Nature Biotechnology, 2007, 25(11): 1322−1326. doi: 10.1038/nbt1359 [3] 蒋智林, 桂富荣, 刘万学, 等. 西花蓟马对寄主植物的危害及其影响机理研究进展 [J]. 安徽农业科学, 2011, 39(19):11529−11530, 11550.JIANG Z L, GUI F R, LIU W X, et al. Research progress of damages and potential mechanisms of Frankliniella occidentalis Pergande on their host plants [J]. Journal of Anhui Agricultural Sciences, 2011, 39(19): 11529−11530, 11550.(in Chinese) [4] UPADHYAY S K, CHANDRASHEKAR K, THAKUR N, et al. RNA interference for the control of whiteflies (Bemisia tabaci) by oral route [J]. Journal of Biosciences, 2011, 36(1): 153−161. doi: 10.1007/s12038-011-9009-1 [5] LU Z C, WAN F H. Using double-stranded RNA to explore the role of heat shock protein genes in heat tolerance in Bemisia tabaci (Gennadius) [J]. Journal of Experimental Biology, 2011, 214(5): 764−769. doi: 10.1242/jeb.047415 [6] 马小丽, 何玮毅, 尤燕春, 等. 小菜蛾鞣化激素基因克隆及其功能分析 [J]. 昆虫学报, 2013, 56(10):1101−1109.MA X L, HE W Y, YOU Y C, et al. Cloning and functional analysis of bursicon genes in the diamondback moth, Plutella xylostella [J]. Acta Entomologica Sinica, 2013, 56(10): 1101−1109.(in Chinese) [7] 王加伟. 小菜蛾卵黄原蛋白受体基因的克隆与表达模式分析[D]. 福州: 福建农林大学, 2016.WANG J W. Molecular cloning and expression profiling of vitellogenin receptor gene in the diamondback moth, Plutella xylostella[D].Fuzhou: Fujian Agriculture and Forestry University, 2016. (in Chinese) [8] 李晓雪. 橘小实蝇RNAi及其对RNAi的免疫耐受机制研究[D]. 武汉: 华中农业大学, 2015.LI X X. RNA interference in Bactrocera dorsalis and the mechanism of its refractoriness to RNA interference[D]. Wuhan: Huazhong Agricultural University, 2015. (in Chinese) [9] 夏文凯. 柑橘全爪螨几丁质合成与代谢途径重要基因的研究[D]. 重庆: 西南大学, 2015.XIA W K. Study on important genes in the biosynthetic and metabolic pathways of chitin in Panonychus citri[D]. Chongqing: Southwest University, 2015.(in Chinese) [10] 鲁秀丽. 沉默两个基因对两种药剂处理的褐飞虱生殖及脂肪体生化影响[D]. 扬州: 扬州大学, 2015.LU X L. Effects of silence of two genes on reproduction of Nilaparvata lugens(Stal) exposed to two insecticides and on biochemistry of fat body[D]. Yangzhou: Yangzhou University, 2015. (in Chinese) [11] 贾东升. 白背飞虱体内RNA干扰技术体系的建立 [J]. 福建农林大学学报(自然科学版), 2013, 42(6):579−583.JIA D S. Establishment of RNA interference system in white-backed planthopper [J]. Journal of Fujian Agriculture and Forestry University(Natural Science Edition), 2013, 42(6): 579−583.(in Chinese) [12] 胡浩. 桔小实蝇注射法RNAi效率提升方法的研究[D]. 重庆: 西南大学, 2017.HU H. Study on the methods to improve RNAi efficiency through dsRNA-injection into Bactrocera dorsalis[D]. Chongqing: Southwest University, 2017. (in Chinese) [13] 马月月, 刘微, 王勇, 等. 柞蚕RR-1亚族表皮蛋白基因ApCP12与ApCP23的表达特征与功能分析 [J]. 昆虫学报, 2018, 61(2):188−199.MA Y Y, LIU W, WANG Y, et al. Expression profiling and functional analysis of RR-1 cuticular protein genes ApCP12 and ApCP23 in Antheraea pernyi(Lepidoptera: Saturniidae) [J]. Acta Entomologica Sinica, 2018, 61(2): 188−199.(in Chinese) [14] 杜明辉, 陈斌, 乔梁. 中华按蚊RNAi技术平台的建立及应用 [J]. 重庆师范大学学报(自然科学版), 2017, 34(1):30−33.DU M H, CHEN B, QIAO L. Establishment and application of RNAi technology of Anopheles sinensis RNAi technology platform [J]. Journal of Chongqing Normal University (Natural Science), 2017, 34(1): 30−33.(in Chinese) [15] CHRISTIAENS O, SWEVERS L, SMAGGHE G. DsRNA degradation in the pea aphid(Acyrthosiphon pisum) associated with lack of response in RNAi feeding and injection assay [J]. Peptides, 2014, 53(3): 307−314. [16] GURA T. A silence that speaks volumes [J]. Nature, 2000, 404(6780): 804−808. doi: 10.1038/35009245 [17] LUO Y. Differential responses of migratory locusts to systemic RNA interference via double-stranded RNA injection and feeding [J]. Insect Molecular Biology, 2013, 22(5): 574−583. doi: 10.1111/imb.12046 [18] PRICE D R G, GATEHOUSE J A. RNAi-mediated crop protection against insects [J]. Trends in Biotechnology, 2008, 26(7): 393−400. doi: 10.1016/j.tibtech.2008.04.004 [19] BADILLO-VARGAS I E, ROTENBERG D, SCHNEWEIS B A, et al. RNA interference tools for the western flower Thrips, Frankliniella occidentalis [J]. Journal of Insect Physiology, 2015, 76(5): 36−46. [20] 陈洁, 陈宏鑫, 姚琼, 等. 甜菜夜蛾UAP的克隆、时空表达及RNAi研究 [J]. 中国农业科学, 2014, 47(7):1351−1361.CHEN J, CHEN H X, YAO Q, et al. Molecular cloning, expression patterns and RNAi of UDP-N-acetylglucosamine pyrophosphorylase in Spodoptera exigua [J]. Scientia Agricultura Sinica, 2014, 47(7): 1351−1361.(in Chinese) [21] 贾东升. SRBSDV和RRSV在介体飞虱体内的侵染机理[D]. 福州: 福建农林大学, 2013.JIA D S. Infection mechanisms of SRBSDV and RRSV in vector planthoppers[D]. Fuzhou: Fujian Agriculture and Forestry University, 2013. (in Chinese) [22] 施秀珍, 吴青君, 王少丽, 等. RNA干扰在昆虫中的作用机理及应用进展 [J]. 生物安全学报, 2012, 21(3):229−235.SHI X Z, WU Q J, WANG S L, et al. The mechanism and application progress of RNA interference in insects [J]. Journal of Biosafety, 2012, 21(3): 229−235.(in Chinese) [23] YANG J, HAN Z. Optimisation of RNA interference—mediated gene silencing in Helicoverpa armigera [J]. Austral Entomology, 2014, 53(1): 83−88. doi: 10.1111/aen.12052 -







 下载:
下载: